 |
Schritte ungeplanter, ungelenkter Entstehung von DNA und RNA?
Simulation von Nichtgleichgewichtsbedingungen in Gesteinsporen heißer Unterwasserquellen
von Peter Imming
Studium Integrale Journal
22. Jahrgang / Heft 1 - Mai 2015
Seite 42 - 45
|
 |
Zusammenfassung: Ein kürzlich erschienener Übersichtsartikel (Mast et al. 2013a) befasst sich mit dem Problem der erstmaligen Entstehung langer Molekülketten, die für lebende Zellen unerlässlich sind. Es wird der Frage nachgegangen, wie unter geologisch plausiblen Nichtgleichgewichtssituationen auf einer frühen Erde die Konzentrierung sowie nachfolgend die Replikation* und Polymerisation* von Biomolekülen stattfinden kann. Geologische Nichtgleichgewichtsbedingungen in Gesteinsporen heißer Unterwasserquellen, die auch für eine frühe Erde angenommen werden, wurden experimentell durch Nachbildung als halboffene Kapillaren mit Temperaturgradienten realisiert. Unter diesen Bedingungen gelingt die Konzentrierung von Biomolekülen; auch die Zusammenlagerung vorgefertigter DNA-Oligomere* wurde experimentell gezeigt. Die Befunde hängen aber von notwendigen, gezielt herbeigeführten Gegebenheiten und Versuchsbedingungen ab. Eine Übertragung auf eine unbeabsichtigte erstmalige Entstehung oder Polymerisation von RNA auf einer hypothetischen frühen Erde ist daher weniger plausibel als die Übertragung auf Bedingungen gezielt herbeigeführter RNA-Herstellung. |  |
|
Konzentrierungsprozesse in Kapillaren
Eines der grundlegenden Probleme einer natürlichen Lebensentstehung ist die Bildung kettenförmiger Makromoleküle wie Proteine, DNA (die Erbsubstanz) und RNA (die Substanz, die biochemisch zwischen Proteinen und DNA steht). Schon die Entstehung ihrer Bausteine (Aminosäuren bzw. Nukleotide) ist problematisch. Als weiterer Schritt in Richtung „Leben“ müsste deren Verknüpfung zu langen Molekülketten (Polymerisation) folgen.
Die Arbeitsgruppe des Biophysikers Dieter Braun widmet sich diesen Problemen. U. a. wurden experimentelle Untersuchungen von physikalisch-chemischen Prozessen durchgeführt, die für den Ursprung erster lebender Systeme von Bedeutung sein könnten (Binder 2012). In diesem Zusammenhang bildeten Mast und Mitarbeiter thermische Gesteinsporen im Labor nach, die auf kleinem Raum hohe Temperaturunterschiede aufweisen (Mast & Braun 2010). Als Modell für Nichtgleichgewichtsbedingungen dienten mit Wasser gefüllte, im Querschnitt rechteckige Glaskapillaren (50 µm x 100 µm), in deren Zentrum die wässrige Lösung mit einem fokussierten Infrarotlaser erwärmt wird. Dadurch wird ein Temperaturunterschied (Gradient) von ca. 10-25 K zwischen dem Kapillarinneren und den Wänden aufrechterhalten (Nichtgleichgewichtsbedingung). Eine solche thermophoretische* Falle lässt die Flüssigkeit und die in ihr gelösten Moleküle durch thermische Konvektion* entlang der langen Achse der Kapillare zirkulieren. Diese Kreisbewegung ist mit einem entsprechenden Transport der im Wasser gelösten Moleküle entlang des thermischen Gradienten verbunden (Thermophorese). Beide Effekte überlagern und verstärken sich gegenseitig und führen lokal zu einer starken Konzentrierung der Moleküle. In einer rein theoretischen Arbeit (Baaske 2007) wurden durch Modellierung weitere Aspekte herausgearbeitet: (1) längere Moleküle werden besser konzentriert als kurze Moleküle, (2) geladene Moleküle wie RNA oder DNA werden dabei bevorzugt, (3) lange Gesteinsporen sind günstig, wobei (4) die vertikale Form der Pore einen geringeren Einfluss hat, (5) eine Porenbreite zwischen 40-400 µm wird benötigt. Allerdings behindern (6) ein Leck an der Unterseite der Pore, sowie (7) eine Strömung von unten nach oben die Konzentrierung erheblich.
Die Autoren präsentierten damit einen experimentell untermauerten Lösungsvorschlag für das Konzentrierungsproblem des Nukleinsäure-Ursprungs. Dafür wird vermutlich eine Erhöhung der Konzentration der präbiotischen* Moleküle um den Faktor 106 bei gleichzeitig erhaltener Beweglichkeit benötigt. Dadurch sollten weitere Reaktionen mit anderen Molekülen wahrscheinlich werden. Das Gleichgewicht würde auf die Seite von Oligo- und Polymeren verschoben, die ja z. B. durch Hydrolyse* abgebaut werden (Baaske 2007). Es muss also nicht nur eine Verknüpfung (Zusammenlagerung) zu Molekülketten erfolgen; diese dürfen auch nicht wieder auseinanderbrechen. Man müsste Nukleotidmonomere in millimolaren Konzentrationen zu Oligonukleotiden hinzufügen, um eine Kettenverlängerung zu erreichen, was auch Mast et al. (2013b) für ein „optimistisches Setting“ halten. Durch die thermophoretische Falle wird ein Entweichen der Moleküle in den umgebenden Ozean verhindert, der die Moleküle nur in sehr hoher Verdünnung enthält, wodurch chemische Reaktionen unwahrscheinlich werden. Allerdings werden die vielen wichtigen, oben genannten Schlussfolgerungen (1)-(7), die mit heutigen Bedingungen in untermeerischen Hydrothermalquellen verglichen werden, vorerst nur aus den Simulationen abgeleitet. Interessant wären weitere Experimente, um diese Schlussfolgerungen zu überprüfen.
Unter den heutigen Hydrothermalquellen scheint nur ein bestimmter Typ als geologisches Pendant in Frage zu kommen: „Lost-City“ (Martin 2009). Die Autoren vergleichen ausführlich die dort vorgefundene Porengeometrie und die abgeschätzten Temperaturgradienten (Baaske 2007). Abgesehen von der Frage, ob ähnliche geometrische Bedingungen auf der frühen Erde existiert haben, ist jedoch zu erwarten, dass das stark alkalische Milieu mit einem pH-Wert zwischen 9 und 11 sowie die immer noch hohen Wassertemperaturen von 40 bis 90 °C ein schwerwiegendes Problem für die weiteren Schritte zur Synthese und dem Erhalt von Polymeren wie RNA, DNA und Proteinen sowie von Kohlenhydraten darstellen. Alle diese Biopolymere sind gegenüber der Hydrolyse und anderen chemischen Reaktionen empfindlich, insbesondere bei erhöhten Temperaturen. Wenn Hydrothermalquellen als weit verbreitetes Milieu auf der frühen Erde angenommen werden, muss man sich generell mit der Frage auseinandersetzen, ob die dortigen chemisch anspruchsvollen Umgebungen die Bildung komplexer Moleküle zulassen.
|
Fluoreszenz: Emission von Energie nach Anregung, wobei die emittierte Energie und deren Frequenz geringer ist als die der Anregung. Fluoreszenzspektroskopie: Eine sehr empfindliche analytische Methode zum Nachweis kleinster Substanzmengen. Sie basiert auf der physikalischen Gegebenheit, dass manche Moleküle, wenn sie mit Licht einer bestimmten Wellenlänge bestrahlt werden, diese Wellenlänge absorbieren und Licht größerer Wellenlänge aussenden, dessen Intensität gemessen wird. Hydrolyse: Auftrennung chemischer Bindungen durch Reaktion mit Wasser. Die Hydrolyse von DNA, RNA, Proteinen und Kohlenhydraten führt zur Entstehung von deren Bausteinen (Monomeren). Hier ist die Hydrolyse also der umgekehrte Vorgang der Polymerisation, die chemisch als Kondensation (Zusammenlagerung zweier Moleküle unter Freisetzung eines Wassermoleküls) bezeichnet wird. Konvektion: Strömung, gemeinsame, gleichzeitige Bewegung von Molekülverbänden unter Mitführung von z. B. Wärmeenergie. kovalente Verknüpfung, kovalente Bindung: So bezeichnet man die Verknüpfung von Atomen, die darauf beruht, dass sie ein Elektronenpaar gemeinsam haben. In Proteinen sind die konstituierenden Aminosäuren über eine kovalente Amidbindung verknüpft. In RNA und DNA sind innerhalb eines Einzelstranges die (Desoxy-)Ribose und Phosphorsäure über kovalente Esterbindungen verknüpft. Die beiden DNA-Stränge einer Doppelhelix sind nicht kovalent, sondern über Wasserstoffbrücken-Bindungen der Basen aneinandergelagert. Monomere: Einzelbausteine, z. B. Aminosäuren bei Proteinen, Nukleotide bei den Nukleinsäuren RNA und DNA und Kohlenhydrate wie Glucose bei Polysacchariden. Nukleotide: die Bausteine (Monomere) von DNA und RNA. Oligomer: aus wenigen bis mehreren Bausteinen bestehendes Molekül. „Oligo“ steht zwischen „mono“ und „poly“, ist nicht eindeutig definiert und wird normalerweise als 10-100 verstanden. Polymerisation: Zusammenfügung von Einzelbausteinen (Monomeren), so dass ein Polymer entsteht, also ein Molekül, das aus vielen Einzelbausteinen besteht. Die wichtigsten Biopolymere: DNA, RNA, Proteine (Eiweiße), Polysaccharide. Präbiotisch: wörtlich „vor dem Leben“; bezieht sich auf einen Zustand oder eine Zeit, zu dem (noch) keine Lebewesen, auch keine einfachsten Zellen vorhanden sind bzw. waren. Präbiotische Chemie fragt nach der Entstehung der Moleküle, die typischerweise und ausschließlich in Lebewesen angetroffen werden und dort konstitutiv sind. Thermophorese: die Bewegung von Teilchen aufgrund eines Temperaturgradienten innerhalb einer Flüssigkeit oder eines Gases.
|
|
|
Auf die Konzentrierung folgende Replikation
Christoph Mast und Dieter Braun nutzten weiterhin den konzentrierenden Effekt der thermophoretischen Falle, um die Replikation einer doppelsträngigen DNA mit 143 Basenpaaren (bp) zu zeigen (Mast & Braun 2010). Da dabei jedoch eine Polymerase-Kettenreaktion mit vorgegebenem Replikatorprotein verwendet wurde, soll hier nicht ausführlicher darauf eingegangen werden. Es wäre ja zunächst zu diskutieren, inwieweit die Synthese (Replikation) einer DNA mit reinen Bausteinen (Nukleotiden*) und einer Polymerase Rückschlüsse auf eine ungeplante, ungelenkte de-novo-Entstehung von DNA und DNA-Replikation erlaubt. Unter präbiotischen Bedingungen sind reine Ausgangsstoffe und eine Polymerase schließlich nicht zu erwarten.
Wichtiger zu diskutieren ist an dieser Stelle die Realisierung eines Polymerisationsmechanismus in einer thermophoretischen Falle (Mast et al. 2013b). Die Polymerisation von Monomeren zu langkettigen Molekülen wird insbesondere innerhalb der RNA-Welt-Hypothese als kritischer Schritt auf dem Weg zu selbst replizierenden Systemen angesehen. Es wird vermutet, dass ein 200bp langes Ribozym benötigt wird, das die weitere RNA-Replikation ermöglicht. Die Autoren um Christof Mast schlagen nun die Polymerisation von RNA-Nukleotiden – also den biochemischen Bausteinen der RNA – insbesondere in Abwesenheit von Polymerasen innerhalb der thermophoretischen Falle vor. Dabei stellt die Konzentrierung von Oligonukleotiden an der geschlossenen Porenseite ein chemisches Nichtgleichgewichtssystem dar, was die weitere Polymerisation begünstigt. Sogar unter Annahme eines reversiblen Polymerisationsmechanismus sagen die Autoren die Existenz 200bp langer RNA-Moleküle mit hinreichend hoher Konzentration im µM-Bereich voraus. Dieses Ergebnis wurde durch Simulationen und durch den Vergleich mit einer analytischen Theorie gewonnen.
Welche experimentellen Belege liefern die Autoren für diese theoretischen Voraussagen? Die Konzentration der Moleküle und der Polymerisationsgrad (eigentlich: Zusammenlagerung vorgefertigter DNA-Stücke mit sticky ends) wurde zeitabhängig durch Fluoreszenzspektroskopie* gemessen. Zur Bestimmung der Konzentration konnten kleine Moleküle, sprich RNA-Nukleotide als Monomere, nicht verwendet werden, da das detektierte Fluoreszenzsignal trotz der Empfindlichkeit der Methode (siehe Glossar) noch zu schwach wäre. Daher wurden DNA-Einzelstränge aus 95 Nukleotiden mit identischer Sequenz verwendet, deren Enden so konstruiert waren, dass sie sich komplementär miteinander zusammenlagern können („sticky ends“). Diese vorgegebenen DNA-Stränge dienten als Modelle für die zu beobachtende Polymerisation (Abb. 1). Sie bilden stabile Doppelstränge. Die „sticky ends“ waren in einer Weise fluoreszenzmarkiert, dass die Bildung des Doppelstrangs in Echtzeit mitverfolgt werden konnte. Die Thermofalle war so aufgebaut, dass vier Thermofallen strömungstechnisch und dank einem asymmetrischen Lasereinstrahlmuster verbunden waren. Als weiteres Detail, das für das Gelingen des Experiments wichtig war, sei noch genannt: Eine Spritzenpumpe mit einer bestimmten optimierten Flussgeschwindigkeit beschleunigte die diffusionskontrollierte Befüllung der Kapillare permanent.
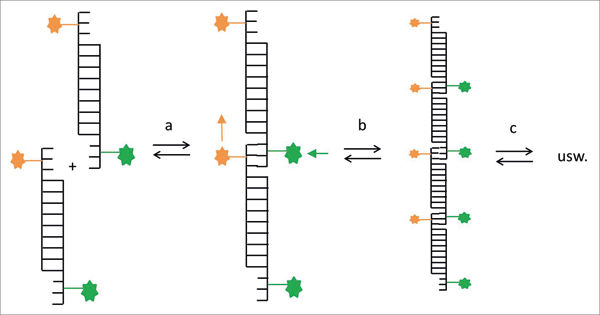 |
| Abb. 1: Schematische Darstellung des experimentellen Modellsystems zum Nachweis der Polymerisation (Mast et al. 2013b). Doppelsträngige DNA-Stücke (95 bp lang) mit zwei komplementären sticky ends (25 bp lang) dienten als „Monomere“ für die Polymerisation. Schritt a zeigt die Zusammenlagerung zweier DNA-Stücke, Schritt b die Zusammenlagerung zweier gemäß a entstandener Oligomere zu einem (verkleinert gezeichneten) längeren Oligomer. Die sticky ends waren mit einem Paar fluoreszierender Farbstoffe (in der Zeichnung gelb und grün) markiert. Wenn sich die DNA-Stücke zusammenlagern, kommen die beiden Farbstoffe einander sehr nahe. Energieübertragung und in der Folge Fluoreszenz, die gemessen wird, tritt auf. Die Lösung der DNA-Stücke wurde in eine Kapillare eingebracht, in der mittels IR-Laser eine Temperaturkonvektion erzeugt wurde. – Verändert nach Mast et al. (2013b). |
|
|
|
Kritische Anmerkungen
Es bleibt fraglich, ob die Polymerisation ausgewählter, vorher hergestellter und in reiner Form dem Versuchsaufbau zugesetzter DNA-Modell-Oligomere eine realistische Abbildung einer eigenständigen RNA-Polymerisation darstellt bzw. sogar der ursprünglichen Entstehung von RNA-Polymeren entsprechen kann. Die Autoren äußern ohne weitere Begründung die Ansicht, diese Vorgabe ändere nichts an der allgemeinen Aussage des Experiments zu Polymerisationsvorgängen. Dabei wurde gar keine Polymerisation im Sinne einer kovalenten Verknüpfung* der Oligonukleotide beabsichtigt und beobachtet, sondern ausschließlich nichtkovalente Zusammenlagerung von DNA-Stücken durch die vorgegebene Komplementarität der sticky ends (s. die Lücken im Rückgrat des Polymers in Abb. 1). Bei der Polymerisation langer RNA-Ketten aber sollte letztlich als Resultat ein RNA-Einzelstrang vorliegen, der durch Verknüpfung von RNA-Nukleotiden entstanden ist. Dabei müssen entlang des RNA-Rückgrats zwischen dem Phosphat eines Nukleotids und der Ribose eines anderen Nukleotids kovalente Bindungen gebildet werden; die Zusammenlagerung zweier Nukleinsäurestränge ist ein chemisch völlig andersartiger Vorgang. Mindestens die folgenden grundsätzlichen Fragen müssen überzeugend beantwortet werden, wenn die referierten DNA-Polymerisationsversuche Aussagekraft für die Entstehung einer RNA-Welt haben sollen:
(1) Die experimentell gewählten DNA-Stränge (Modell-Oligomere) sind chemisch deutlich verschieden von einzelnen RNA-Nukleotiden. Daher muss sichergestellt werden, dass ihr oligomerer Charakter inklusive komplementärer sticky ends sie trotzdem zu geeigneten Modellen für RNA-Polymerisation macht. Natürlich müsste zuerst auch noch ihre Entstehung und die Synthese ihrer Bausteine plausibel gemacht werden.
(2) Durch die 25bp sticky ends am DNA-Strang sind die Wechselwirkungsbedingungen mit einem anderen DNA-Modell-Oligomer vorgegeben und werden durch nichtkovalente Wasserstoffbrückenbindungen realisiert. Diese Wechselwirkung hat nichts mit der zu zeigenden Bildung kovalenter Bindungen entlang dem Rückgrat einer RNA-Kette zu tun.
 |
| „Zeit“ ist kein Ersatz für kausalmechanische Vorgänge, nach denen hier (bisher vergeblich) gesucht wird. Ähnlich wie anderen Termini wird der Zeit hier das kreative Vorgehen zugeordnet, das die Forscher geleistet haben. |
 |
|
(3) RNA ist im Vergleich zu DNA chemisch weniger stabil und wird viel schneller durch Reaktion mit Wasser (Hydrolyse) in die Bausteine gespalten. Auch insofern ist die Übertragbarkeit von Experimenten mit DNA auf RNA im chemischen Detail, um das es in den Arbeiten ja geht, gründlich zu überprüfen.
Robert Shapiro, ein bekannter Forscher auf dem Gebiet der ursprünglichen Entstehung von Biomolekülen, hat schon vor einigen Jahren in Scientific American einen Vergleich gezogen, der auch für die hier referierten Experimente zuzutreffen scheint: „Das zentrale Problem lässt sich anhand einer Analogie erläutern: Nachdem ein Golfer einen 18-Loch-Kurs erfolgreich absolviert hat, behauptet er, der Ball hätte das auch ohne ihn schaffen können – unter der Einwirkung natürlicher Kräfte – wenn man ihm nur genügend Zeit gelassen hätte“ (Shapiro 2007). „Zeit“ ist aber kein Ersatz für kausalmechanische Vorgänge, nach denen hier (bisher vergeblich) gesucht wird. Ähnlich wie anderen Termini wird der Zeit hier das kreative Vorgehen zugeordnet, das die Forscher geleistet haben. „Lange Zeiten“ wirken sich gerade bei Biomolekülen außerhalb lebendiger Zellen und Organismen jedoch nicht kreativ, sondern zerstörerisch aus (synthetisierte Molekülverbände neigen aufgrund des chemischen Gleichgewichts dazu, sich wieder aufzulösen).
|
Literatur
- Baaske P, Weinert FM, Duhr S, Lemke KH, Russell MJ & Braun D (2007)
- Extreme Accumulation of nucleotides in simulated hydrothermal pore systems. Proceedings of the National Academy of Sciences 104, 9346-9351.
- Binder H (2012)
- Wurde die RNA-Welt am Grunde des Ozeans etabliert? Stud. Integr. J. 19, 61-62.
- Mast C & Braun D (2010)
- Thermal Trap for DNA Replication. Physical Review Letters 104, 188102.
- Mast C, Möller FM & Braun D (2013a)
- Lebendiges Nichtgleichgewicht. Physik Journal 12, Nr. 10.
- Mast C, Schink S, Gerland U & Braun D (2013b)
- Escalation of polymerization in a thermal gradient. Proceedings of the National Academy of Sciences 110, 8030-8035.
- Martin W (2009)
- Hydrothermalquellen und der Ursprung des Lebens. Biologie in unserer Zeit 39, 166ff.
- Shapiro R (2007)
- A simpler origin for life. In: Scientific American June, Nr. 2, Jg. 296, S. 23-31; auf Deutsch in: Spektrum der Wissenschaft, November 2007, S. 65-72. S. 67.
-
|
|  |
