 |
Erstaunliches Experiment: Flosse zu Bein umgewandelt?
von Reinhard Junker & Henrik Ullrich
Studium Integrale Journal
20. Jahrgang / Heft 2 - Oktober 2013
Seite 101 - 104
|
 |
Zusammenfassung: Durch molekulargenetische Manipulationen gelang es einer Forschergruppe, wurmförmige Anlagen statt Beckenflossen bei Zebrafischembryonen hervorzubringen. Ist damit ein wichtiger Schlüssel zum Verständnis der Entstehung von Vierbeinern aus Fischvorfahren gefunden?
|  |
|
Einleitung
 |
| Abb. 1: Mikroskopische Darstellung eines feingeweblichen Schnittes in Höhe des Kopfes und des Rumpfes einer Zebrafischlarve 96 Stunden nach Befruchtung (Größe der gesamten Larve ca. 4 mm; das Bild zeigt nur den vorderen Teil der Larve). Die Anlagen für die Flossen sind als seitliche Bändchen (ca. 200 µm lang) unterhalb des Kopfes sichtbar, am Ende der Bändchen finden sich links mehr als rechts kölbchenartige Auftreibungen (Pfeile). Diese resultieren als Folge einer experimentell angeregten Hoxd13-Überexpression an den Spitzen der Flossen mit vermehrter Bildung von Knorpelvorläuferzellen, was als latente Fähigkeit zur Ausbildung eines Autopodiums von den Forschern interpretiert wird. (Aus Freitas et al. 2012) |
|
Als einer der wohl wichtigsten evolutionären Übergänge bei Wirbeltieren gilt der Schritt vom Wasser ans Land und damit der mutmaßliche Umbau von Fischen zu Vierbeinern. Neben fossilen Funden werden heute vielfältige molekulargenetische Untersuchungen herangezogen, um herauszufinden, wie dieser Übergang vonstatten gegangen sein könnte. Sollte sich dieser hypothetische evolutive Umbau tatsächlich ereignet haben, wären davon zahlreiche Funktions- und Baumerkmale betroffen gewesen, unter anderem gilt dies für die Extremitäten: Flossen hätten zu Armen und Beinen umkonstruiert werden müssen. Typisch für die Vierbeiner-Gliedmaßen ist deren Dreiteilung in Stylopodium (Oberarmknochen, Humerus bzw. Oberschenkelknochen, Femur), Zeugopodium (Elle und Speiche bzw. Schienbein und Wadenbein) und Autopodium (Hand- bzw. Fußwurzelknochen, Mittelhand- bzw. Mittelfußknochen und Finger- bzw. Zehenknochen). Diese charakteristische Unterteilung fehlt bei Fischen. Lediglich manche Extremitätenknochen der Quastenflosser erlauben andeutungsweise einen Vergleich mit Stylo- und Zeugopodium. Dagegen gilt das Autopodium allgemein als evolutionäre Neuheit ohne Homologie mit Bauelementen der Fischflossen. Beim Erwerb der Vierbeinerextremität gingen andererseits die Flossenstrahlen der Fischflossen verloren.
Nun ist es Forschern gelungen, durch experimentelle Manipulation an Embryonen von Zebrafischen die Ausbildung wurmförmiger, an Beinchen erinnernder Strukturen an den Stellen auszulösen, wo sich die Brustflossenanlagen befinden (Abb. 1). Die dafür erforderlichen künstlich herbeigeführten Änderungen der genetischen Regulation des Flossenwachstums beim Zebrafisch wurden durch ausgeklügelte experimentelle Veränderungen des Erbguts und durch das gezielte Einspritzen von biologisch wirksamen Substanzen (Hormone) in den Embryo ermöglicht. Kleine Ursache – große Wirkung? Wurde damit ein Schlüssel gefunden, wie aus Fischflossen Beine von Vierbeinern werden konnten?
|
Die Forscher injizierten – den im Text beschriebenen Überlegungen folgend – in einem Experiment spezifisch veränderte Hoxd13-Genvektoren (HoxGR mRNAs, col2a1a:Hoxd13a mRNAs und hsp70:Hoxd13a mRNAs) in die befruchteten Eizellen von Zebrafischen. Diese Vektoren bauten das veränderte Hoxd13 Gen in das Erbgut des Zebrafischembryos ein. Die veränderten Hoxd13-Gene waren so gestaltet, dass sie eine deutlich höhere Aktivität in der Gegenwart von spezifischen Hormonen wie dem Glucokorticoidhormon Dexamethason oder einem Hitzeschockprotein aufwiesen. Diese Hormone wurden während ausgewählter Entwicklungsphasen (z. B. nach 24, 30, 32 und 48 Stunden) dem sich entwickelnden Embryo zugegeben. Als Ergebnis des Experimentes zeigte sich, dass bei 40% der so behandelten Embryonen die sich entwickelnden Flossenstrahlen verplumpten, in ihrer Breitenentwicklung gehemmt und Knorpelzellen an der Spitze der nun wurmförmigen ausgebildeten Flossenanlagen gebildet wurden. Dort waren sie sonst nicht zu finden. Knorpelzellen sind auch Vorläufer für die Ausbildung von Knochengewebe.
In einem zweiten Experiment wurden spezielle Enhancer für das Hoxd13-Gen der Maus (mCsC) über einen ähnlichen Mechanismus wie oben beschrieben in das Erbgut des Zebrafisches eingebracht. Deren Expressionsmuster und das durch sie veränderte Expressionsmuster des Hoxd13-Gens dokumentierte man während der Ausbildung der Flossenanlage. Diese Muster ähnelten denen, die auch bei einem Mäuseembryo auftreten.
|
|
|
|
Von der normalen Entwicklung zur Ausbildung von „Beinchen“
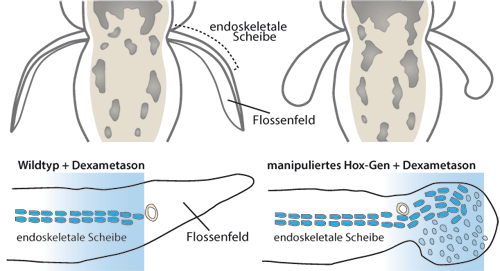 |
| Abb. 2: Oben: Schematische Gegenüberstellung der Flossenentwicklung bei Zebrafischlarven mit (rechts) und ohne (links) experimentelle Manipulation mit Überexpression des Hoxd13a-Gens und nach Hormon-injektion (vgl. auch Abb. 1). Die verplumpte Anlage der Flosse und die Auftreibung an der Flossenspitze sind bei der manipulierten Larve deutlich sichtbar. (Nach Schneider & Shubin 2012) Unten: Vergrößerter Querschnitt durch die Flossenanlage; Knorpelzellen blau. Das hellblaue Band zeigt die Region der Expression spezifischer Hox-Gene und ihrer Enhancer (Verstärker) für die Gliedmaßenentwicklung (u. a. Hoxd13a), links Wildtyp mit Behandlung von Dexametason, rechts manipulierte Larve mit Überexpression von Hoxd13a-GR und nach Injektion von Dexametason. Das Schema verdeutlicht, dass in der manipulierten Larve sich die Expresssionsregion von Hoxd13a und der Enhancer deutlich nach peripher verschiebt und in der Flossenspitze Knorpelvorläuferzerzellen zusätzlich gebildet werden. (Nach Freitas et al. 2012) |
|
Um die Bedeutung der „Beinchen“ des Zebrafisches einschätzen zu können, werfen wir einen Blick auf die normale ontogenetische Entwicklung von Beinen und Flossen. In den sich entwickelnden Flossen wird wie bei den Extremitäten der Landwirbeltiere zunächst ein Auswuchs, die sogenannte apikale ektodermale Randleiste (AER) gebildet, die bei der Brustflosse der Fische bald zu einer Flossenfalte wird. Das Wachstum eines Innenskeletts erfolgt im Vergleich mit Vierbeinern auf einem deutlich niedrigeren Niveau. Sowohl in den Anlagen der Fischflossen als auch in denen der Gliedmaßen der Vierbeiner sind spezifische Hoxd-Gene in dieser ersten Phase aktiv, aber nur bei den Vierbeinern erfolgt eine Aktivierung dieser Hoxd-Gene in einer zweiten späteren Phase im Zusammenhang mit der Bildung der körperfernen Teile inklusive der Finger (also des Autopodiums).
Daher wird vermutet, dass der Ursprung der Extremitäten durch eine insgesamt gesteigerte Aktivität des Hoxd-Gens mitverursacht wurde und die Entstehung des Autopodiums mit einer neu erworbenen zweiten Phase der Hoxd-Gen-Aktivität korreliert. Diese zweite Phase wird bei Vierbeinern durch einige Enhancer getriggert, die bei Fischen fehlen. (Enhancer bewirken eine vermehrte Nutzung eines Gens.) Wenn nun bei Fischen 1. die Hoxd-Genaktivität durch eine zeitlich abgestimmte Gabe von Hormonen in einer späteren Phase erhöht wird und 2. die fehlenden Enhancer in das Erbgut der Fische eingebracht und aktiviert werden, könnten die so induzierten Funktionssteigerungen der Hoxd-Gene in späteren Entwicklungsphasen bei Fischen zu vergleichbaren Ergebnissen wie bei Mäuseembryonen führen, also zur embryonalen Anlage von Extremitäten. So lautete der prinzipielle Ansatz einer Forschergruppe um Josè Luis Gómez-Skarmeta (Freitas et al. 2012; vgl. Schneider & Shubin 2012). Ihre Versuche werden im Textkasten beschrieben.
Diese Experimente schlagen gleich zwei Fliegen mit einer Klappe, da beide Änderungen (eine gesteigerte Aktivität des Hoxd13a-Gens und die Wirksamkeit zusätzlicher Enhancer) auch beim evolutiven Umbau einer Flosse in eine Extremität hypothetisch angenommen werden müssen. Denn es wurden sowohl die sich entwickelnden Flossenstrahlen in der Entwicklung gehemmt als auch Knorpelzellen an der Spitze der nun wurmförmig ausgebildeten Flossenanlagen gebildet (Abb. 2). Insbesondere die Ausdehnung und Neuordnung der Expressionsdomänen (Gebiet, in dem ein Gen abgelesen und damit genutzt wird) des Hoxd13-Gens und seiner Enhancer in der verkleinerten Flossenfalte bis zur Spitze ist beeindruckend. Dieser Befund bedeutet auch, dass im Erbgut des Zebrafisches genetische Regelkreise vorliegen, welche mit den eingebrachten Enhancern wechselwirken konnten. Die Hochregulierung von Hoxd13 könnte also in der evolutionären Geschichte der Vierbeiner mittels neu erworbener Enhancer (s. o.) erfolgt sein, was denselben Effekt hätte wie die künstliche Erhöhung von Hoxd13-Aktivität durch die gezielten Hormonbehandlungen.
|
|
|
|
Welche Schlussfolgerungen erlaubt dieses Experiment?
Fischembryonen starben recht rasch nach den Behandlungen ab, da u. a. das spezifisch überaktivierte Hoxd13-Gen zu Unverträglichkeiten mit anderen Körperfunktionen führte, die nicht mit dem Leben und der Entwicklung des Zebrafischembryos vereinbar waren. Auf den gesamten Organismus bezogen führten die Versuche also in eine Sackgasse.
 |
| Auf den gesamten Organismus bezogen führten die Versuche in eine Sackgasse. |
 |
|
Im Hinblick auf die Entwicklung einer Vierbeiner-Extremität erlauben die Experimente keinerlei Aussagen bezüglich ihrer Folgen für das weitere Wachstum, die Gestaltung und die Differenzierung der sich entwickelnden Extremität. Dass man den entstandenen wurmförmigen Anhang als „Beinchen“ bezeichnet, entspricht der Zielsetzung des Experiments und dem Wunsch der Wissenschaftler, nicht dem tatsächlichen Ergebnis. Denn es fehlt eine Bauplanähnlichkeit der künstlich erzeugten „Beinchen“ mit Beinen von Landwirbeltieren. Wenn man zusätzlich berücksichtigt, dass Beine ohne Verbindung mit einem Becken oder Arme ohne Verbindung mit dem Schultergürtel, die wiederum fest an der Wirbelsäule verankert sind, ihre Funktion nicht wahrnehmen können, erscheint die Bezeichnung „Beinchen“ mehr als gewagt. An dieser Stelle sei auch darauf hingewiesen, dass das embryonale Rohmaterial für die Bildung der bindegewebigen Strukturen wie Knochen, Knorpel und Muskeln bei Fischen z. T. aus anderen Quellen stammt als bei den Landwirbeltieren (Boisvert et al. 2013).
Fakt ist, dass sich wurmförmige Anhängsel gebildet haben genau an den Stellen, die als Ausgangspunkt für eine Evolution von einer Brustflosse zu einer Land-Extremität vermutet werden. Die Expressionsmuster (Muster der Nutzung) einzelner Gene in diesen Anhängseln weisen zum Teil Ähnlichkeiten mit denen der Extremitätenanlagen bei Mäusen auf.
Fakt ist aber auch, dass diese von Menschen gezielt durchgeführten Experimente nicht dazu führten, lebensfähige Organismen hervorzubringen oder dass sich ähnliche Veränderungen auch im Bereich anderer Flossen vollzogen.
Dies sind nicht die einzigen Gründe, weshalb weitergehende Schlussfolgerungen aus diesem sicher bemerkenswerten Experiment nur mit Zurückhaltung möglich sind. So mahnt zur Vorsicht auch die Tatsache, dass die heutigen Zebrafische relativ weit von den mutmaßlichen Vorfahren der Landwirbeltiere entfernt sind, sowohl morphologisch als auch zeitlich (nämlich 400 Millionen Jahre nach radiometrischen Datierungen). Daher wirkt die evolutionäre Interpretation der experimentellen Daten eher gezwungen, wenn man meint, dass ein gemeinsames evolutionäres Erbe – wie die oben beschriebene Sensitivität auf die Enhancer der Hoxd13-Gene – im Erbgut bei Maus und Zebrafisch vorliegen könnte. Welche Selektionsdrücke könnten dieses genetische Potential zur Extremitätenentwicklung beim Zebrafisch über einen solch langen Zeitraum aufrechterhalten?
Die beobachteten Veränderungen beim Zebrafisch sprechen eher für krankhafte Entwicklungsstörungen ausgelöst durch genetische und medikamentöse Beeinflussung der Embryonalentwicklung.
 |
Es fehlt eine Bauplanähnlichkeit der künstlich erzeugten „Beinchen“ mit
Beinen von Landwirbeltieren. |
 |
|
Man kann an dieser Stelle zwar argumentieren, dass aus zunächst nachteiligen oder krankmachenden Ausgangsbedingungen für das Individuum vorteilhafte Veränderungen entstehen können, wenn sich Umweltbedingungen entsprechend ändern. Aber welche Selektionsdrücke und welche Umweltbedingungen könnten den Erhalt der in den Experimenten erzeugten morphologischen Varianten begünstigen? Welche genetischen Mechanismen sind in der Lage, die in den Experimenten intelligent vollzogenen Umbauten des Erbgutes zu realisieren? Auf diese Fragen wird im Artikel der Forscher und in den vielen Kommentaren nicht eingegangen.
Für sich alleine genommen sind die beschriebenen künstlichen Veränderungen jedenfalls nicht vorteilhaft, selbst wenn man zugunsten des evolutionstheoretischen Arguments davon absieht, dass Zebrafische sich vom mutmaßlichen Landwirbeltier-Vorfahren erheblich unterscheiden (s. o.). Die durch die Experimente erfolgten Abwandlungen der Brustflossen würden selbst ohne den oben erwähnten fatalen Kollateralschaden keinerlei Vorteil für einen Fisch bringen. Dafür wären Hand in Hand gehende zahlreiche weitere abgestimmte Änderungen erforderlich, die dem Träger einer solch umgebauten Extremität wenigstens keinen Nachteil bescheren. Mit den so erzeugten „Beinchen“ kann der Fisch nichts anfangen, er stirbt ihretwegen bereits, bevor er diese in irgendeiner Weise nutzen kann.
Auch wenn beim hypothetischen Übergang vom Wasser ans Land nicht alle dafür erforderlichen Umbauten gleichzeitig erfolgen müssen: Eine isolierte Betrachtung von lediglich einzelnen Aspekten wird der biologischen Realität hier wie an vielen anderen Stellen nicht gerecht.
|
Literatur
- Boisvert CA, Joss JMP & Ahlberg PE (2013)
- Comparative pelvic development of the axolotl (Ambystoma mexicanum) and the Australian lungfish (Neoceratodus forsteri): conservation and innovation across the fish-tetrapod transition. EvoDevo 2013, 4:3, doi:10.1186/2041-9139-4-3
- Freitas R, Gómez-Marín C, Wilson JM, Casares F & Gómez-Skarmeta JL (2012)
- Hoxd13 Contribution to the Evolution of Vertebrate Appendages. Dev. Cell, dx.doi.org/10.1016/j.devcel.2012.10.015
- Schneider I & Shubin NH (2012)
- Making Limbs from Fins. Dev. Cell, dx.doi.org/10.1016/j.devcel.2012.11.011
|
|  |
