 |
|
von Reinhard Junker
Studium Integrale Journal
21. Jahrgang / Heft 2 - Oktober 2014
Seite 64 - 72
|
 |
Zusammenfassung: Im unteren Teil der geologischen Periode des Kambriums ist eine große Anzahl unterschiedlichster Tierbaupläne erstmals fossil überliefert. Dieses plötzliche Erscheinen wird in der Fachwelt häufig als „kambrische Explosion“ bezeichnet. Ältere Formen des Präkambriums repräsentieren eigene Baupläne und sind kaum als Vorläufer der kambrischen Tierwelt interpretierbar.
|  |
|
Einleitung
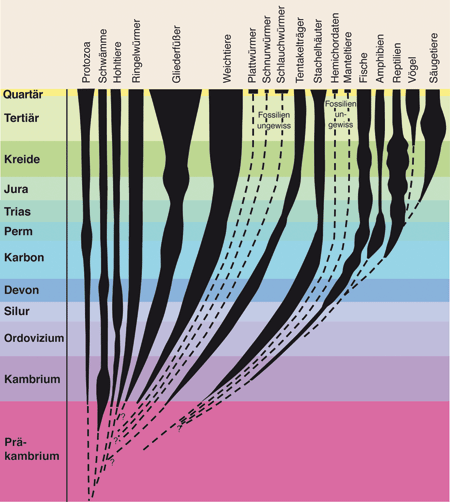 |
| Abb. 1: Grober Überblick über die fossile Dokumentation von Tierstämmen im Phanerozoikum* sowie der Klassen des Stamms der Chordatiere (Fische bis Säugetiere). (Nach Czihak et al. 1981, verändert) |
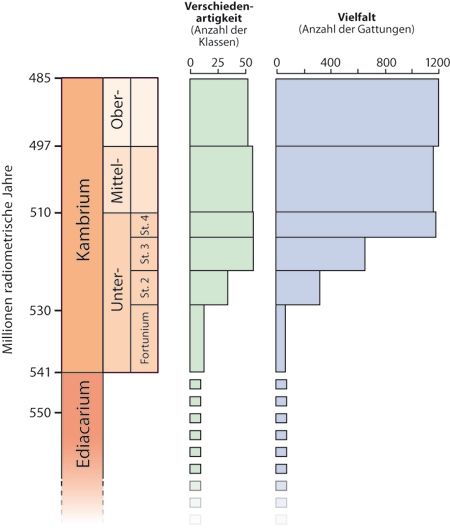 |
| Abb. 2: Kambrische Explosion, dargestellt anhand der Anzahl der Klassen (Verschiedenartigkeit, disparity) und der Anzahl der Gattungen (Vielfalt, diversity). Im oberen Teil des Unterkambriums erfolgt eine rasante Zunahme. St.=Stufe. Stufe 2 wurde früher als Tommotium, Stufe 3 als Atdabanium bezeichnet. Diese Bezeichnungen werden im Text teilweise beibehalten, insbesondere in Zitaten. (Nach Marshall 2006, vereinfacht) |
|
Die Präkambrium-Kambrium-Grenze in der geologischen Periodenfolge markiert die größte Diskontinuität in der Fossilüberlieferung (vgl. Abb. 1, 2). Der untere Teil des Kambriums ist durch eine große Anzahl erstmals fossil erhaltener Tiergruppen in enormer Verschiedenartigkeit* gekennzeichnet, während vergleichbare Formen oder passende Vorstufen in tieferen Schichten des oberen Präkambriums weitgehend fehlen. Daher wird bis heute in der Paläontologie (Fossilforschung) von der „kambrischen Explosion“ gesprochen (Valentine 2004, Erwin & Valentine 2013).
Lebewesen aus allen bekannten Tierstämmen*, die Hartteile besitzen, sind in kambrischen Schichten (meist bereits im Unterkambrium) vertreten. Zu den im Kambrium vertretenen Tierstämmen gehören z. B. Schwämme (Porifera), Hohltiere (Coelenterata), Ringelwürmer (Annelida), Armfüßer (Brachiopoda), Gliederfüßer (Arthropoda), Weichtiere (Mollusca), Stachelhäuter (Echinodermata) und auch Chordatiere (Chordata; darunter als „erste“ Wirbeltiere auch kieferlose Fische). Diese Tierstämme sind zudem von Beginn ihres fossilen Nachweises an in der Regel in verschiedene, deutlich abgrenzbare Untergruppen (Klassen*) aufgespalten (Cooper & Fortey 1998, 152) und geographisch meist weit verbreitet. Die verschiedenartigen Tiergestalten sind zudem durch komplexe Beziehungen miteinander verbunden; es tauchen also ganze Ökosysteme plötzlich in komplexer Form auf; ihre fossile Überlieferung endet oft ebenso abrupt.
Die Verschiedenartigkeit der Formen innerhalb der einzelnen Stämme ist häufig von Beginn ihrer Fossilüberlieferung an beträchtlich. So kommt das Ausmaß der gestaltlichen Unterschiede unter den kambrischen Gliederfüßern der Spanne heutiger Formen nahe. „Bis zum späten Unterkambrium sind sowohl Verschiedenartigkeit als auch Breite der Taxa* ebenso groß wie diejenige in heutigen Ozeanen oder übertreffen diese sogar“ (Fortey et al. 1996, 16; die Formen selber sind aber verschieden von den heutigen). Ähnlich stellt auch Erwin (1999, 622f.) fest: „... alle zeigen die entwicklungsgeschichtliche Breite der Entwicklungslinien zur Zeit der frühkambrischen Phase der Radiation.“ Zu den auch heute vertretenen Tierstämmen kommen zahlreiche Formen hinzu, bei denen unklar oder umstritten ist, ob sie sich überhaupt an bekannte Tierstämme anschließen lassen und die den kambrischen Reichtum an Tiergestalten noch erheblich vergrößern (Gould 1991).
Thomas et al. (2000) stellen 182 Strukturelemente skeletttragender Tierstämme zusammen (sowohl von Innen- als auch Außenskeletten) und weisen nach, dass 146 davon in den Skeletten des mittelkambrischen Burgess-Schiefers vorkommen. „Innerhalb von 15 Millionen Jahren des Erscheinens der Kronengruppen der Tierstämme mit Hartteilen als wesentlichem Bestandteil sind mindestens 80% der Skelett-Designelemente, die unter heutigen und ausgestorbenen marinen Vielzellern bekannt sind, genutzt worden“ (Thomas et al. 2000, 1239).
Die hauptsächlichen Unterschiede zwischen den Bauplänen der Tierwelt waren also zu Beginn der dokumentierten Fossilüberlieferung vielzelliger Organismen bereits vorhanden. Valentine (2004) stellt in seiner Monographie der kambrischen Tierwelt fest, dass sich dieser markante Einschnitt seither durch viele Forschungen bestätigt hat. Fortey et al. (1996, 23) stellen außerdem fest: „Es gibt kaum Fossilien, welche auf Verbindungen zwischen den Stämmen hinweisen.“ Und nach Valentine (2004, 31, 35) sind von keinem einzigen Stamm die Vorläufer bekannt, ebenso sei der Weg der Entstehung bei allen Klassen der Wirbellosen unbekannt. Differenzierung innerhalb der Stämme oder der Klassen in jüngeren Schichten sind zwar immer noch sehr erheblich, aber in ihrem Ausmaß geringer als während der postulierten, aber fossil weitgehend nicht belegten hypothetischen vorkambrischen Evolution (Erwin et al. 1997, 126).
Die kambrische Explosion als schwerwiegendes evolutionstheoretisches Problem
 |
„Es gibt kaum Fossilien, welche
auf Verbindungen zwischen den Stämmen hinweisen.“ |
 |
|
Nach Gould (1991, 38) war evolutionstheoretisch erwartet worden, dass bei schrittweiser Evolution (dem Evolutionsmodus der Synthetischen Evolutionstheorie) die Verschiedenartigkeit der Lebewesen allmählich größer werden sollte, und er sprach in diesem Sinne vom „Kegel wachsender Verschiedenheit“ (s. u.; Abb. 6). Das Bild, das der kambrische und präkambrische Fossilbericht zeigt, ist davon deutlich verschieden, wie die bisherigen Ausführungen schon zeigten. Daraus ergeben sich mehrere evolutionstheoretische Probleme: Weshalb fehlen passende Vorstufen und Bindeglieder weitgehend? Wie können – Evolution vorausgesetzt – in so kurzer Zeit derart viele ganz unterschiedliche Baupläne entstehen? Diese Fragen haben das Potential, eine evolutive Entstehung der kambrischen Tierwelt in Frage zu stellen.
Kritik
Der explosive Charakter des fossilen Erscheinens der kambrischen Vielfalt der Tierbaupläne wird von manchen Autoren jedoch bestritten und entsprechende Darstellungen werden kritisiert. Die wichtigsten Kritikpunkte kann man wie folgt zusammenfassen: 1. Die kambrische Explosion sei bei weitem nicht so explosiv wie das oft behauptet wird. 2. Es gebe durchaus Erklärungen dafür, wie die neuen Baupläne in kurzer Zeit entstehen konnten. Das auch als „Darwins Dilemma“ benannte evolutionstheoretische Problem der kambrischen Explosion sei durchaus lösbar, wenn nicht sogar bereits gelöst. Die nachfolgenden Ausführungen widmen sich dem ersten Kritikpunkt. Zum zweiten Kritikpunkt ist ein Beitrag in der nächsten Ausgabe von Studium Integrale Journal vorgesehen.
|
Im unteren Teil der erdgeschichtlichen Periode des Kambriums (Abb. 1, 3) ist eine große Anzahl von Tiergruppen in enormer Verschiedenartigkeit* fossil überliefert, während vergleichbare Formen oder passende Vorstufen in älteren Schichten des Präkambriums weitgehend fehlen. Dieses ziemlich abrupte Erscheinen einer vielgestaltigen Tierwelt wird als „kambrische Explosion“ bezeichnet.
Es ist mittlerweile zwar eine erhebliche Anzahl von Vielzellern auch im Präkambrium entdeckt worden, doch handelt es sich dabei häufig um Formen, die nicht als Vorstufen der kambrischen Tierwelt gewertet werden, sondern eigene Linien repräsentieren, die früh ausgestorben sind (v. a. die Ediacara-Fauna). Die präkambrischen Formen erscheinen ihrerseits in drei Faunenvergesellschaftungen ebenfalls relativ abrupt. Auch die vielfältigen winzig kleinen (< 2mm) beschalten Fossilien im untersten Kambrium (sog. „small shelly-Fauna“) eignen sich nur teilweise als mögliche Vorläufer; für ihr Auftreten können ökologische Gründe wahrscheinlich gemacht werden. In den unterkambrischen Stufen des Tommotiums und Atdabaniums (Stufen 2 und 3 in der neueren Nomenklatur, vgl. Abb. 2) nimmt die Verschiedenartigkeit der Formen rasant zu; diese Phase von ca. 6-10 Millionen radiometrischen1 Jahren wird meistens als eigentliche kambrische Explosion bezeichnet. Radiationen* im jüngeren Kambrium und Ordovizium führen zu keiner markanten Erhöhung der Verschiedenartigkeit der Tierstämme mehr; während des Kambriums wird in der Regel bereits das Maximum an Verschiedenartigkeit der Tierstämme erreicht. Nur relativ wenige Formen werden als mögliche Vorläufer der kambrischen Tierstämme diskutiert, ihre Natur ist meist umstritten. Eine Anzahl neuerer Fossilfunde vergrößert die kambrische Vielfalt noch weiter.
1 Altersangaben beruhen auf radiometrischen Datierungen, sie sind nicht absolut zu verstehen, sondern von Voraussetzungen abhängig (vgl. Kotulla 2014).
|
|
|
Wie explosiv war die kambrische Explosion?
Der Begriff „Explosion“ soll in diesem Artikel beschreibend verstanden werden, ebenso die Begriffe „erscheinen“ und „auftauchen“. Diese Begriffe sollen zum Ausdruck bringen, dass eine erhebliche Vielfalt von Lebensformen abrupt fossil in Erscheinung tritt, ohne dass damit zugleich eine Aussage über die Entstehungsweise gemacht werden soll. Evolutionstheoretiker benutzen diesen Begriff dagegen als Metapher, mit der eine sehr schnelle Evolution beschrieben werden soll.
Einige Forscher behaupten, die kambrische Explosion habe sich über einen langen Zeitraum von bis zu 80 Millionen Jahren hingezogen, so dass der Begriff „Explosion“ gar nicht gerechtfertigt sei, sondern einer veralteten Sicht entspreche. Entsprechende Behauptungen finden sich vor allem im Internet. Zwei Experten auf dem Gebiet der kambrischen Paläontologie, Douglas Erwin und James Valentine, haben dagegen ihrem im Jahr 2013 erschienenen Buch den Titel „The Cambrian Explosion“ gegeben. Nachfolgend soll gezeigt werden, dass die Aufblähung auf 80 Millionen Jahre unsachgemäß ist, da verschiedene Aspekte der Paläontologie des Kambriums und des Präkambriums (insbesondere des Ediacariums als letzter Periode des Präkambriums) durcheinander gebracht werden, wodurch das evolutionstheoretische Problem des plötzlichen Erscheinens verschleiert wird. Man muss hier nämlich vier Aspekte unterscheiden:
- Die vorkambrische Fossilüberlieferung,
- die „small shelly-Fauna“ zu Beginn des Kambriums,
- das Erscheinen zahlreicher Tierbaupläne im Unterkambrium (die eigentliche „kambrische Explosion“) und
- die weitere Radiation dieser Baupläne bzw. das Erscheinen von Untergruppen und Kronengruppen im Verlauf des Kambriums (und später).
Die Vermischung dieser vier Aspekte ist deshalb unsachgemäß, weil die vorkambrischen Fossilien nur in wenigen Fällen als mögliche Vorläufer einiger weniger kambrischer Formen diskutabel sind und weil viele Baupläne erstmals tatsächlich in einem engen Zeitfenster erscheinen.
|
|
Die Ediacara-Fauna und andere vorkambrische Faunen
 |
| Abb. 3: „Ediacara-Fauna“: eigenartige, hartkörperlose Organismen, die erstmals 1946 bei Ediacara (Australien) entdeckt und inzwischen auf fast allen Kontinenten gefunden wurden. Näheres im Text. (Nach Gould 1991) |
|
Die kambrische Tierwelt umfasst nicht die ersten bzw. ältesten Vielzeller. Auch aus dem Präkambrium (vgl. Abb. 1) sind Vielzeller-Fossilien bekannt, vor allem die rätselhafte Ediacara-Fauna. Sie verschwindet großenteils zu Beginn des Kambriums wieder von der Bildfläche, einige Formen sind auch noch aus dem Kambrium bekannt (Narbonne 2005).
Bei der Ediacara-Fauna handelt es sich meist um eigenartige, zentimeter- bis dezimetergroße Organismen, fast ausschließlich ohne inneres oder äußeres Skelett (Abb. 3). Sie wurde erstmals 1946 bei Ediacara (Australien) entdeckt und inzwischen auf fast allen Kontinenten gefunden. Es handelt sich um rätselhafte Organismen: Seilacher (1992) sieht in ihnen spezialisierte einzellige Mikrobenhüllen, „lebende Luftmatratzen“ (mit Protoplasma gefüllte Pneus), ohne innere Organe; die Körperhüllen sind in sehr verschiedener Weise mit Lamellen abgesteppt. Angesichts der ungewöhnlichen Baupläne ist die taxonomische* Einordnung hoch umstritten, weil meist keine klaren gemeinsamen anatomischen Details mit anderen Gruppen vorliegen. Die Ediacara-Fossilien wurden schon als Protozoen (Einzeller), als flechtenartige Organismen, als Verwandte der Nesseltiere (Cnidaria, z. B. Quallen), als Schwestergruppe der Cnidaria und dem Rest der Tiere, als Repräsentanten weiterentwickelter Stämme, als Repräsentanten eines neuen Reiches oder als Vertreter einer der bekannten Stämme (Nesseltiere, Plattwürmer, Ringelwürmer, Gliederfüßer, Stachelhäuter) interpretiert (Narbonne 2005, 431f.). Eine klare Beziehung zu bekannten Stämmen ist somit nicht nachvollziehbar oder mindestens fraglich. Darüber besteht unter den Bearbeitern weitgehend Einigkeit (vgl. Z-1). Die Ediacara-Fauna birgt daher so gut wie keine geeigneten Vorläufer für die im Kambrium auftauchenden Formen, mit eventueller (umstrittener) Ausnahme der Weichtiere, Schwämme, vielleicht Nesseltiere und einem Wurm-Stamm – gegenüber etwa 30 nachgewiesenen kambrischen Stämmen (Meyer 2013, 81-97; Narbonne 2005, 433).
Ediacara-Fossilien wurden mittlerweile an über 30 Lokalitäten auf mehreren Kontinenten gefunden und bislang sind mehr als 270 Arten beschrieben worden. Sie werden im System der Historischen Geologie in die Zeitspanne zwischen 575-542 Millionen radiometrische Jahre datiert und repräsentieren die ältesten bekannten komplexen makroskopischen Lebensformen (Shen et al. 2008, 81). Man unterscheidet heute drei verschiedene biostratigraphische* Vergesellschaftungen: Avalon (579-560 Ma), White Sea (560-550 Ma) und Nama (550-541 Ma) (Erwin 2011, 1039; Narbonne 2005; Waggoner 2003). Die drei Vergesellschaftungen sind jeweils auf einen bestimmten Lebensraum beschränkt und repräsentieren drei hauptsächliche Ökotypen in einem globalen Umfang (Grazhdankin 2011, 343). Zu weiteren Details siehe Z-2.
Fazit. Insgesamt kann gefolgert werden, dass eine Verbindung zwischen der vorkambrischen Organismenwelt und der kambrischen Explosion nicht nachgewiesen oder allenfalls sehr schwach ist (Erwin et al 1997, 132). Es ist daher nicht gerechtfertigt, die kambrische Explosion auf die zeitlich vorangehende Ediacara-Fauna des Präkambriums auszudehnen.
|
Biostratigraphie: Schichtbeschreibung auf der Basis des Fossilinhalts. Chorda: Elastischer Stützstab entlang der Körperachse bei den danach benannten Chordatieren. Cladismus, cladistisch: Auf quantifizierbare Daten basierende Taxonomie, in der alle verfügbaren Merkmale von Organismen gleichberechtigt berücksichtigt werden, um Verwandtschaftsbeziehungen in einem Baumdiagramm darzustellen. Cladogramm: Baumdiagramm, Ähnlichkeitsbaum (→ Cladismus); auch als Dendrogramm bezeichnet. homolog: bauplangleich, als „abstammungsbedingt ähnlich“ interpretiert. Kambrium: Erdgeschichtliche Periode, in der in großer Zahl und Verschiedenartigkeit zahlreiche Tierbaupläne erstmals fossil überliefert sind (vgl. Abb. 1,2). Klasse: Die nächst feinere Unterteilung von -> Tierstämmen. Phanerozoikum: Das Phanerozoikum umfasst alle geologischen Systeme, die in großem Umfang Vielzeller-Fossilien bergen, vom -> Kambrium bis heute (vgl. Abb. 1). „Phanerozoikum“ bedeutet „das Leben erscheint“ (in fossil erhaltener Form). Mittlerweile ist auch im jüngeren Präkambrium eine Reihe von Vielzellergruppen entdeckt worden (vgl. Abschnitt „Ediacara-Fauna“). Radiation: Entstehung vieler unterschiedlich angepasster Arten aus einer Stammform in relativ kurzer Zeit. Sediment(gestein): Durch Ablagerung entstandene Schichten bzw. geschichtetes Gestein. Taxon, pl. Taxa: Klassifikationseinheit in der → Taxonomie, z. B. Art, Gattung, Familie. Taxonomie: Biologische Arbeitsrichtung, die die Mannigfaltigkeit der Organismen beschreibt, benennt und ordnet. Tierstämme: Das Tierreich wird in Stämme unterteilt, die Unterschiede zwischen den Stämmen sind also maximal; man kann sagen, die Stämme stehen für die größten Bauplanunterschiede. Die Stämme werden weiter unterteilt in → Klassen. Trilobiten: Dreilappige Krebstiere. Verschiedenartigkeit und Vielfalt: Mit Verschiedenartigkeit (disparity) wird die morphologische Variation, also die Unterschiedlichkeit von Bauplänen innerhalb einer größeren Formengruppe bezeichnet, im Gegensatz zur Vielfalt (diversity) innerhalb eines engen Verwandtschaftskreises. Beispielsweise würde man Hunderassen als vielfältig bezeichnen, dagegen sehr verschiedene Säugetierarten (etwa von Fledermaus bis Blauwal) als verschiedenartig.
|
|
|
Die „small shelly-Fossilien“ an der Basis des Kambriums
In der untersten Stufe des Unterkambriums (Abb. 2) ist eine kleinwüchsige (< 2 mm) beschalte Fauna fossil überliefert (Abb. 4); einige mit erkennbar moderner Struktur, während von den meisten Mitgliedern dieser Fauna nur „winzige Klingen, Hauben und Becher von unbestimmter Zugehörigkeit“ gefunden wurden (Gould 1991, 60). Diese Fauna ist unter der Bezeichnung „small shelly-Fauna“ bekannt geworden. Die small shelly-Fauna hat phosphathaltige Schalen, ist weltweit verbreitet, taucht zeitgleich mit phosphatführenden Sedimenten auf und verschwindet mit deren Ausklingen wieder – ein deutlicher Hinweis auf ökologische Zusammenhänge (vgl. Maloof et al. 2010, 1750f., 1752; Erwin & Valentine 2013, 151; Stephan 1994). Die nachfolgenden Organismen besitzen dagegen Karbonate als vorrangiges Baumaterial. Die Diversität der small shelly-Fossilien ist erheblich und dürfte viele verschiedene Linien repräsentieren (Erwin & Valentine 2013, 149). Auch wenn viele small shelly-Fossilien kaum verstanden seien, repräsentieren sie nach Erwin & Valentine (2013, 151) doch eine große und phylogenetisch getrennte Gruppe, die auf ein enges Zeitfenster beschränkt ist.
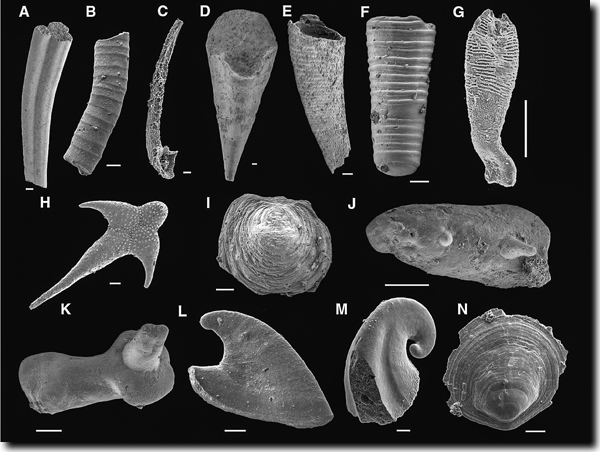 |
| Abb. 4: Kambrische small-shelly-Fossilien. A Anabarites tripartitus (Anabaritidae, inc. sed.); B Hyolithellus sp. (Hyolithelminthes); C Protohertzina unguliformis (Protoconodonta); D hyolithomorpher Hyolith; E Conotheca brevica (orthothecimorpher Hyolith); F Cupitheca sp. (inc. sed.); G Australohalkieria superstes (Coeloscleritophora, Halkieriidae); H Archiasterella hirundo (Coeloscleritophora, Chancelloriidae); I Micrina sp. (Tommotiidae); J Paracarinachites sinensis (Paracarinachitida); K Cambroclavus fangxianensis; L Anabarella simesi (Mollusca); M Pelagiella deltoides (Mollusca); N Ocruranus finial. Länge der Balken jeweils 0,1 mm. (Aus Maloof et al. (2010), Fig. 2; aus verschiedenen Quellen zusammengestellt; © Geological Society of America; http://www.geosociety.org/pubs/copyrt.htm) |
|
Eine phylogenetische Beziehung der small shelly-Fauna zu den später im (Unter-)Kambrium auftauchenden Tiergruppen ist unklar. Marshall (2006) sieht keine engere Verbindung der small shelly-Fossilien mit den hauptsächlichen Innovationen der kambrischen Tierwelt der unterkambrischen Stufen des Tommotiums und Atdabaniums (Stufen 2 und 3; vgl. Abb. 2). Er stuft viele als taxonomisch problematisch und schwer zu diagnostizieren ein, „selbst auf dem taxonomischen Niveau von Tierstämmen“. Lediglich einige Formen können Armfüßern (Brachiopoda) oder Weichtieren (Mollusca) zugeordnet werden (Marshall 2006, 360; Maloof et al. 2010, 1735). Marshall & Valentine (2010, 1193) schließen die small shelly-Fauna von dem „zehn Millionen Jahre dauernden geologisch abrupten Erscheinen von Fossilien ganz verschiedener Baupläne“ aus.
 |
| Die Beziehung der small shelly-Fauna zu den später auftauchenden Tiergruppen ist unklar. |
 |
|
Auch wenn einzelne small shelly-Fossilien möglicherweise einigen bekannten Tierstämmen zugeordnet werden können, ändert dies nichts daran, dass mit Beginn des Tommotiums abrupt eine weitaus größere Formenvielfalt auftritt (vgl. Abb. 2). Die small shelly-Fauna ist daher nicht geeignet, die kambrische Explosion nennenswert zu entschärfen.
|
|
Das Erscheinen zahlreicher Tierbaupläne im Unterkambrium
Mit der „kambrischen Explosion“ ist diejenige Phase des Kambriums gemeint, in der der größte Teil der morphologischen Innovation fossil erstmals belegt ist (und in diesem Sinne „auftaucht“). In evolutionstheoretischer Deutung heißt das: Der Hauptteil der in der Sedimentationsabfolge des Kambriums dokumentierten morphologischen Innovationen erfolgte in einem Zeitfenster von nur 5-6 Millionen, allenfalls 10 Millionen Jahren (Bowring et al. 1993, 1297). Dabei tauchen mindestens 16 neue Tierstämme und etwa 13 Klassen erstmals im Fossilbericht auf (vgl. Abb. 2, 5). Dies wird in einer neueren Arbeit von Erwin et al. (2011, Fig. 1) im Grundsatz ebenso bestätigt wie von Erwin & Valentine (2013) in ihrem jüngst erschienenen Buch „The Cambrian Explosion“ (S. 5): Eine große Verschiedenartigkeit und ein großer Reichtum von Tierfossilien erscheine in einem geologisch kurzen Intervall von 530 bis 520 Millionen Jahren im Unterkambrium. Fast alle größeren skeletttragenden heute lebenden Stämme erscheinen mit komplexen Organen erstmals in fossiler Form. Die Autoren sprechen von einem „geologisch abrupten“ Erscheinen, es gebe keine schöne Abfolge des Erscheinens zunehmend komplexerer Organismen. Sie unterstreichen, dass die Grundstruktur der Ökosysteme des Phanerozoikums* innerhalb von höchstens 10 Millionen Jahren nach dem Beginn der Diversifizierung der Bilaterier (Zweiseitentiere) erreicht worden sei. Die magere fossile Überlieferung vor dem Kambrium erlaube nicht die Rekonstruktion der Baupläne der letzten gemeinsamen Vorfahren der kambrischen Stämme außer in einem sehr allgemeinen Sinne (Marshall & Valentine 2010, 1194). Die frühen kambrischen marinen Ökosysteme erscheinen so komplex wie moderne Ökosysteme, zumindest in Bezug auf ihre Ernährungsbeziehungen (Erwin & Valentine 2013, 234). Die noch frühere Fauna enthält dagegen nicht zahlreiche große, komplizierte Baupläne (Erwin & Valentine 2013, 6). (Zahlreiche Zitate, wonach für die kambrische Explosion maximal ca. 10 Millionen Jahre zu veranschlagen sind, sind in Z-3 zusammengestellt.)
 |
| Abb. 5: Vielfalt von Bauplänen, die im Unterkambrium fossil überliefert sind. A Anomalocaris (Lobopoda, inc. sed.; ca. 50-100 cm lang), B Eognathacantha ercainella (Chaetognatha, Pfeilwürmer), C Cotyledion tylodes (Entoprocta, Kelchwürmer; Kelchbreite ca. 6 mm), D Dinomischus (incertae sedis; ca. 3 cm), E Lingulella chengjiangensis (Brachiopoda, Armfüßer; Schale ca. 1 cm), F Hallucigenia (Onychophora, Stummelfüßer, inc. sed.; ca. 5 cm), G Haikouichthys (Chordata, Vertebrata; ca. 3 cm), H Wiwaxia (incertae sedis ; ca. 5 cm), I Leanchoilia (Arthropoda, Gliederfüßer; ca. 5 cm), J Stromatocystites (Echinodermata). – Quellen: A, D, F, H nach Gould 1991 und Marianne Collins; B Wikimedia Commons, Apokryltaros (Wikipedia, CC SA 3.0), C aus Zhang et al. (2013), E Quelle unbekannt, G Wikimedia Commons, Nobi Tamura (CC BY-SA 3.0), I Wikimedia Commons, CC BY-SA 3.0, J www.echinologia.com |
|
Valentine & Jablonski (2003, 520) fassen zusammen: „[A]lle Klassen der wirbellosen Meerestiere sind im Verborgenen entstanden – sie können nicht mit ihren Ahnen durch intermediäre Formen in Verbindung gebracht werden – was auf viele andere Ordnungen ebenfalls zutrifft. Insofern verhalten sich die Taxa wie die Stämme, die wie oben beschrieben ebenfalls kryptogenetisch sind.“
Die Feststellung, dass die eigentliche kambrische Explosion bzw. ihr Hauptteil in einer Zeitspanne von maximal 10 Millionen radiometrischen Jahren erfolgt, wird von zahlreichen Autoren geteilt (Nachweis unter Z-3). Somit ist es im evolutionstheoretischen Rahmen unsachgemäß und irreführend, wenn die kambrische Explosion auf das gesamte Kambrium oder noch darüber hinaus ausdehnt wird.
Bei der Diskussion um die Dauer der eigentlichen kambrischen Explosion darf zudem nicht aus den Augen verloren werden, dass auch eine langsame Evolution nicht die Entstehung der Baupläne und das Fehlen von Zwischenformen erklärt. Gerade wenn man eine allmähliche Entstehung der Baupläne annimmt, wäre die Fossilüberlieferung von weitaus mehr Bindegliedern zu erwarten.
Bindeglieder oder Mosaikformen? Befinden sich unter den unterkambrischen Fossilien Formen, die als evolutionäre Bindeglieder interpretiert werden könnten? Manche Formen weisen einen Mix aus Merkmalen auf, die typisch sind für verschiedene Tierstämme. Solche Mosaikformen sind als gemeinsame Vorläufer der betreffenden Stämme jedoch ungeeignet; um als Bindeglied passend zu sein, müssten ihre Merkmale in Bezug auf die verbindenden Tierstämme jeweils primitiv sein. Eine mosaikartige Verteilung von Merkmalen bei verschiedenen Taxa führt zu netzförmigen Verbindungen, die nur durch Annahmen von Konvergenzen in einen Stammbaum „übersetzt“ werden können. Anders ausgedrückt: Die Formen nähern sich zur Basis der Fossilüberlieferung hin nicht an, sondern weisen unterschiedliche Mosaike auf. „Manche davon erscheinen wie eine Mischung aus mehreren der bekannten Gruppen, andere ähneln überhaupt nichts Bekanntem, außer vielleicht irgendwelchen letzten Überlebenden der Ediacara-Fauna“ (Janvier 2003). Beispiele sind Vestustovermis (Chen et al. 2005), Nectocaris (Conway Morris 1976, Smith & Caron 2010, Bengtson 2010), Hurdia (Daley et al. 2009) oder Vetulicola (Luo 2004). Zu weiteren Details siehe Z-5; einige diskutierte Vorläufer der kambrischen Tierwelt werden in Z-6 vorgestellt.
|
|
Verschiedenartigkeit vor Vielfalt
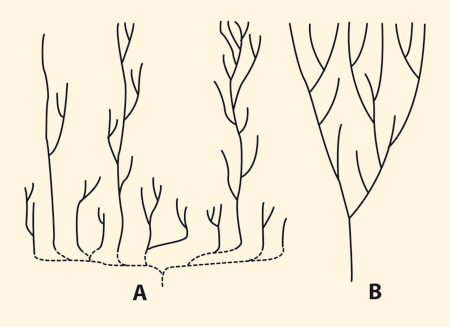 |
| Abb. 6: Das punktualistische (A) und das gradualistische (B) Modell („Kegel wachsender Verschiedenheit) in Stammbaumdarstellungen. (Nach Gould 1991) Es bestehen signifikante Lücken zwischen den Tierstämmen von Anfang an. Gould (1991) charakterisierte das Muster des fossilen Erscheinens von Taxa, das bei gradueller Evolution zu erwarten ist, als „Kegel wachsender Verschiedenheit“ (Abb. rechts), d. h. von älteren zu jüngeren Schichten sollte die Verschiedenartigkeit allmählich zunehmen. Aber weder die kambrische noch die heutige marine Fauna zeige dieses Muster, vielmehr sind die Baupläne ausgesprochen in Äste mit einzigartigen Konstruktionen gruppiert, mit auffälligen Lücken im architektonischen Stil, und dieses Muster ist auch bei Klassen innerhalb der Stämme und bis zu einem gewissen Ausmaß auch bei den Ordnungen innerhalb der Klassen festzustellen (vgl.Erwin & Valentine 2013, 340). |
|
Die kambrische Explosion ist nicht nur wegen des plötzlichen Erscheinens vieler Baupläne markant, sondern auch deshalb, weil während des Kambriums in der Regel bereits das Maximum an Verschiedenartigkeit der Tierstämme erreicht wird (Valentine 2004, 35, 431; innerhalb der Tierstämme gibt es allerdings die bekannten erheblichen Veränderungen des Formenspektrums vom Kambrium bis heute; nur das Ausmaß der Verschiedenartigkeit wird nicht mehr größer). Der Fossilbericht zeigt vielfach zwei Muster: Explosionen morphologischer Innovation und danach Stabilität von Bauplänen über große Zeiträume hinweg (Davidson & Erwin 2010, 184; Erwin & Valentine 2013, 157). Das ist das klare Gegenteil von ursprünglichen evolutionstheoretischen Erwartungen. Beispielsweise sind unter den Gliederfüßern die größeren Untergruppen im Unter- und Mittelkambrium präsent, ebenso eine Reihe von Stammgruppen der Arthropoden, die verschiedenen Linien angehören (Budd & Telford 2009). Dieses Muster trifft besonders auf die Stachelhäuter (Echinodermen) zu: Eine Reihe von Stammgruppen-Echinodermen, zweiseitig symmetrische und dreistrahlige Formen eingeschlossen, erscheint im Unterkambrium, und bis zum Ordovizium können 21 Stachelhäuter-Klassen unterschieden werden. Aber die morphologischen Merkmale, durch die die fünf fünfstrahligen Echinodermen-Klassen definiert werden, die bis heute überlebt haben, sind seit dem Ordovizium stabil geblieben (Davidson & Erwin 2010, 185). Zu einer ähnlichen Feststellung gelangen Newman & Bhat (2008,1f.) und stellen ausdrücklich fest, dass dieses Muster evolutionstheoretisch nicht vorhergesagt wurde (vgl. auch Erwin & Valentine (2013, 213).
Frühe Vielfalt auch innerhalb der Tierstämme
Erwin & Valentine (2013) erwähnen bei mehreren Tierstämmen früh etablierte Vielfalt, die wiederum nicht evolutionär zu erwartenden Mustern folgt: So sind einerseits sehr früh Fossilien von Schwämmen überliefert, andererseits weisen einige von ihnen Kombinationen von Merkmalen auf, die Kronengruppen zugeordnet werden oder einzigartig sind, weshalb entweder deren unabhängige Entstehung oder nachträglicher Verlust angenommen werden müsse (S. 159). Die erste nachweisbare Radiation der Rippenquallen (Ctenophora) gehe weit über das heutige Ausmaß hinaus, ebenso gebe es an der Basis des Kambriums eine beträchtliche Vielfalt bei den Nesseltieren (Cnidaria) (S. 165). Die Stachelhäuter (Echinodermata) zeigen das allgemeine Muster der Vielzeller, nämlich einer früh etablierten großen Spanne verschiedenartiger Gestalten (S. 169); mehr als 20 Echinodermen-Klassen im Kambrium und Ordovizium stehen fünf heute lebenden gegenüber (S. 170).
 |
Verschiedenartigkeit vor Vielfalt ist
das Gegenteil von früheren evolutionstheoretischen Erwartungen. |
 |
|
Auch Fossilien aller drei heute lebenden Chordaten-Unterstämme (Cephalochordaten, Urochordaten und Wirbeltiere) finden sich ab Stufe 3 des Unterkambriums (S. 174) (vgl. Abb. 2). Die Ecdysozoa („Häutungstiere“) erscheinen im Kambrium morphologisch ähnlich kompliziert wie die heutigen Formen, es handelt sich aber fast ausschließlich um Stammformen heutiger Kronengruppen (S. 179). Die morphologische Diversität der Extremitäten kambrischer Lobopoden und Onychophora (Stummelfüßer) sei viel größer als bei heutigen Formen (S. 187, 189, 202). Kronen-Krebstiere (Crustacea) finden sich unter den frühen kambrischen Fossilien (S. 202). Kambrische Ringelwürmer (Annelida)-Fossilien werden zwar nicht heutigen Gruppen zugeordnet, seien aber morphologisch genauso komplex wie deren Kronengruppen (S. 203). Diese Gruppe zeige 520 Millionen Jahre lang eine „außerordentlich konservative morphologische Form“. Und schließlich seien alle Klassen und 14 von 27 Ordnungen der Armfüßer (Brachiopoda) im Kambrium nachgewiesen worden (S. 213).
|
|
Neuere Funde, die die kambrische Explosion „verstärken“
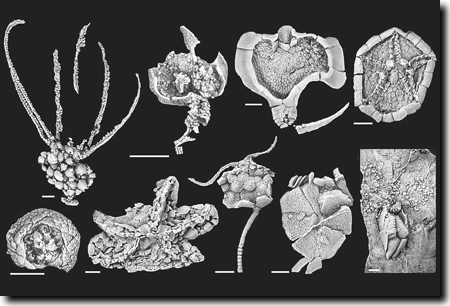 |
| Abb. 7: Verschiedene Stachelhäuter-Gruppen (Echinodermen) aus dem Mittelkambrium Spaniens. (Aus Zamora et al. 2010, Abdruck mit freundlicher Genehmigung) |
|
Nach wie vor werden Funde gemacht, die das Ausmaß der kambrischen Explosion eher vergrößern als verringern. Einige Beispiele aus der Forschung der letzten Jahre sollen kurz vorgestellt werden (Details siehe Z-7).
- Eine neuere Studie hat gezeigt, dass die Priapuliden (Priapswürmer) schon wenige Millionen Jahre nach ihrem erstmaligen fossilen Nachweis zu Beginn des Kambriums eine Variationsbreite erreicht haben, die der heutigen annähernd gleichkommt (Wills et al. 2012).
- Im Nordwesten Kanadas wurden in Flachmeer-Ablagerungen aus dem mittleren bis späten Kambrium zahlreiche neue Funde von Körperanhängen krebsartiger Tiere beschrieben (Harvey et al. 2012). Sie konnten z. B. Branchiopoden (Blattfuß- oder „Urzeitkrebse“), Copepoden (Ruderfußkrebse) und Ostracoden (Muschelkrebse) zugeordnet werden. Teilweise zeigten sie überraschende Ähnlichkeiten mit heute lebenden Formen. Die Autoren stellen fest, dass die früheste Radiation von Krebsartigen, die zu den oben beschriebenen verschiedensten Formen geführt haben muss, „im Fossilbericht kryptisch“, also nicht belegt sei.
- In jüngerer Zeit wurden mehrere Funde von sehr gut erhaltenen Komplexaugen unterkambrischer Fossilien gemacht. Sie demonstrieren, dass Augen im Fossilbericht nicht primitiv beginnen, sondern in komplexer Form, vergleichbar den Komplexaugen heutiger Gliederfüßer (Lee et al. 2011). Manche dieser fossilen Komplexaugen können es mit den leistungsfähigsten Facettenaugen heutiger Gliederfüßer aufnehmen. Paterson et al. (2011) schließen aus der Größe der Augen, dass auch das Gehirn hochentwickelt gewesen sein muss.
- Eine Vielzahl von Fossilfunden verschiedenster Taxa von Stachelhäutern (Echinodermen) aus dem untersten Mittelkambrium Spaniens (Abb. 7) wurde im Jahr 2010 beschrieben (Zamora 2010). Sie erweitern das bekannte Formenspektrum beträchtlich. Da viele dieser Taxa fast am Beginn des Mittelkambriums fossil erscheinen, müsse ihr Ursprung wahrscheinlich ins Unterkambrium vorverlegt werden (so Zamora).
- Metanauplius-Larven von Wujicaris muelleri sind die ältesten bisher entdeckten Larven von Krebsen aus dem Unterkambrium Chinas (Zhangsend et al. 2010). Ihr Körperbau erinnert stark an heutige Krebse in diesem Entwicklungsstadium, zum Beispiel an Ruderfüßer oder Seepocken.
|
|
Fazit
Paläontologisch stellt sich die Fossilüberlieferung des Ediacariums und des Unterkambriums nach wie vor als ausgesprochen explosiv dar. Das heißt: Der Hauptteil der Tierstämme und viele Klassen innerhalb der Stämme erscheinen erstmals in einem engen geologischen Zeitfenster von 6-10 Millionen Jahren. Viele neuere Funde vergrößern die Vielfalt kambrischer Formen. Der Großteil präkambrischer Formen eignet sich nicht als Vorläuferformen kambrischer Organismen und erfordert eigene Entstehungshypothesen. Dieser Befund widerspricht evolutionstheoretischen Erwartungen. Mechanismen für das abrupte Erscheinen der vielfältigen Tierwelt des Kambriums sind nicht bekannt. Es werden verschiedene biotische und abiotische Auslöser der Explosion diskutiert; sie sind alle umstritten und ermöglichen keine Erklärung.
|
Literatur
- Bengtson S (2010)
- A little kraken wakes. Nature 465, 427-428.
- Bowring SA, Grotzinger JP & Isachsen CE (1993)
- Calibrating rates of early Cambrian evolution. Science 261, 1293-1298.
- Budd GE & Telford MJ (2009)
- The origin and evolution of arthropods. Nature 457, 812-817.
- Chen JY, Huang DY & Bottjer DJ (2005)
- An Early Cambrian craniate-like chordate. Nature 402, 518-522.
- Conway Morris S (1976)
- Nectocaris pteryx, a new organism from the Middle Cambrian Burgess Shale of British Columbia. N. Jb. Geol. Paläont. Mh., S. 705-713.
- Cooper A & Fortey R (1998)
- Evolutionary explosions and the phylogenetic fuse. Trends Ecol. Evol. 13, 151-156.
- Czihak G, Langer H & Ziegler H (1981)
- Biologie: Ein Lehrbuch. Berlin, Heidelberg.
- Daley AC, Budd GE, Caron JB, Edgecombe GD & Collins D (2009)
- The Burgess shale anomalocaridid Hurdia and its significance for early euarthropod evolution, Science 323, 1597-1600.
- Davidson EH (2011)
- Evolutionary bioscience as regulatory systems biology. Dev. Biol. 357, 35-40.
- Davidson EH & Erwin (2010)
- Evolutionary innovation and stability in animal gene networks. J. Exp. Zool. 314B, 182-186.
- Dzik J (1993)
- Early metazoan evolution and the meaning of its fossil record. In: Hecht MK et al. (eds) Evolutionary Biology, vol. 27, 339-366.
- Erwin DH (1999)
- The origin of bodyplans. Am. Zool. 39, 617-629.
- Erwin D, Valentine J & Jablonski D (1997)
- The origin of animal body plans. Am. Sci. 85, 126-137.
- Erwin DH, Laflamme M, Tweedt SM, Sperling EA, Pisani D & Peterson KJ (2011)
- The Cambrian conundrum: Early divergence and later ecological success in the early history of animals. Science 334, 1091-1097.
- Erwin DH & Valentine JW (2013)
- The Cambrian explosion. The construction of animal biodiversity. Greenwood Village, Colorado.
- Fortey RA, Briggs DEG & Wills MA (1996)
- The Cambrian evolutionary ‘explosion’: decoupling cladogenesis from morphological disparity. Biol. J. Linn. Soc. 57, 13-33.
- Gould SJ (1991)
- Zufall Mensch. München – Wien; Original 1989: Wonderful Life. New York: W. W. Norton & Co.
- Grazhdankin D (2011)
- Ediacaran biota. In: Reitner J & Thiel V (eds) Encyclopedia of Geobiology. doi: 10.1007/978-1-4020-9212-1, pp 342-348.
- Harvey THP, Vélez MI & Butterfield NJ (2012)
- Exceptionally preserved crustaceans from western Canada reveal a cryptic Cambrian radiation. Proc. Natl. Acad. Sci. 109, 1589-1594.
- Janvier P (2003)
- Die explosive Entstehung der Tierwelt. Spektr. Wiss. 5/2003.
- Kotulla M (2014)
- Gültigkeit und Grenzen geologischer Zeitbestimmung. Online-Loseblattsammlung, Stand: 1. Ergänzungslieferung 03/2014, www.wort-und-wissen.de/loseblattsammlung.html.
- Lee MSY, Jago JB, García-Bellido DC, Edgecombe GD, Gehling JG & Paterson JR (2011)
- Modern optics in exceptionally preserved eyes of Early Cambrian arthropods from Australia. Nature 474, 631-634.
- Maloof AC, Porter SM, Moore JL, Dudas FO, Bowring SA, Higgins JA, Fike DA & Eddy MP (2010)
- The earliest Cambrian record of animals and ocean geochemical change. Geol. Soc. Amer. Bull. 122, 1731-1774.
- Marshall CR (2006)
- Explaining the Cambrian ‘explosion’ of animals. Ann. Rev. Earth Planet. Sci. 34, 355-384.
- Marshall CR & Valentine JW (2010)
- The importance of preadapted genomes in the origin of the animal bodyplans and the Cambrian explosion. Evolution 64, 1189-1201.
- Meyer SC (2013)
- Darwin’s Doubt. The explosive origin of animal life and the case for intelligent design. New York.
- Narbonne GM (2005)
- The Ediacara biota: Neoproterozoic origin of animals and their ecosystems. Annu. Rev. Earth Planet. Sci. 33, 421-442.
- Newman SA & Bhat R (2008)
- Dynamical patterning modules: physico-genetic determinants of morphological development and evolution. Phys. Biol. 5, 015008, 1-13.
- Paterson RJ, García-Bellido DC, Lee MSY, Brock GA, Jago JB & Edgecombe GD (2011)
- Acute vision in the giant Cambrian predator Anomalocaris and the origin of compound eyes. Nature 480, 237-240.
- Seilacher A (1992)
- Vendobionta als Alternative zu Vielzellern. Mitt. Hamb. Zool. Mus. Inst. 89, Erg.bd. 1, 9-20.
- Shen B, Dong L, Xiao S & Kowalewski M (2008)
- The Avalon explosion: Evolution of Ediacara morphospace. Science 319, 81-84.
- Smith M & Caron JB (2010)
- Primitive soft-bodied cephalopods from the Cambrian. Nature 465, 469-472.
- Stephan M (1994)
- Neuere Forschungen zur Lebewelt im Kambrium und Jung-Präkambrium – ein Überblick. Stud. Integr. J. 1, 4-11.
- Thomas RDK, Shearman RM & Stewart GW (2000)
- Evolutionary exploitation of design options by the first animals with hard skeletons. Science 288, 1239-1242.
- Valentine JW (2004)
- On the origin of phyla. Chicago and London.
- Valentine JW & Jablonski D (2003)
- Morphological and developmental macroevolution: a paleontological perspective. Int. J. Dev. Biol. 47, 517-522.
- Waggoner B (2003)
- The Ediacaran Biotas in Space and Time. Integr. Comp. Biol. 43, 104-113.
- Wills MA, Gerber S, Ruta M, Hughes M (2012)
- The disparity of priapulid, archaeopriapulid and palaeoscolecid worms in the light of new data. J. Evol. Biol. 25, 2056-2076.
- Zamora S (2010)
- Middle Cambrian echinoderms from north Spain show echinoderms diversified earlier in Gondwana. Geology 38, 507-510.
- Zhangsend XG, Maas A, Haug JT, Siveter DJ & Waloszek D (2010)
- An eucrustacean metanauplius from the Lower Cambrian. Curr. Biol. 20, 1075-1079.
- Weitere Literatur siehe ZL-1 im Online-Zusatzmaterial.
-
|
|  |
