 |
|
von Harald Binder
Studium Integrale Journal
20. Jahrgang / Heft 2 - Oktober 2013
Seite 94 - 98
|
 |
Zusammenfassung: Leistungsfähige Sequenzierungsmethoden ermöglichen Genomanalysen in einem bisher unvorstellbaren Umfang. Dadurch können neue Fragestellungen aufgenommen werden. Schwere Infektionskrankheiten wie Malaria und Cholera haben Auswirkungen auf das menschliche Genom. Lassen sich Spuren der Auseinandersetzung mit Infektionskrankheiten im Erbgut von Menschengruppen nachweisen, die über Generationen hinweg damit konfrontiert waren? Liegt in der Konfrontation mit Infektionen ein Potential zur Veränderung des menschlichen Genoms? Kann dadurch neue genetische Information entstehen?
|  |
|
Einleitung und Problemstellung
Aus veröffentlichten Daten der Weltgesundheitsorganisation (WHO) geht hervor, dass von den Todesfällen in der Weltbevölkerung etwa 15 % auf Infektionen durch Bakterien oder Viren und durch Parasiten verursachte Krankheiten zurückgehen, in Afrika bis 41%. Im Bericht von 2012 werden für das Jahr 2011 4,4 Millionen Todesfälle von Kindern unter 5 Jahren aufgrund von Infektionen angegeben (Cagliani & Sironi 2013).
Lebewesen, die mit Infektionen konfrontiert sind, haben im Immunsystem ein sehr leistungsfähiges Instrumentarium, Herausforderungen dieser Art zu begegnen. Darüber hinaus finden sich aber auch im Erbgut (Genom) des Menschen Spuren der Auseinandersetzung mit infektiösen Krankheitserregern. Die modernen und leistungsfähigen Technologien zur Analyse von Genomen eröffnen in diesem Forschungsfeld zunehmend neue Einblicke. Wie kann man besondere Merkmale in DNA-Sequenzabschnitten feststellen und mit entsprechenden Infektionsereignissen in Zusammenhang bringen?
Zunächst müssen viele Genome derselben Art, in diesem Fall Erbgut von Menschen (Humangenome), vollständig und exakt sequenziert werden. Man benötigt viele Proben, die von genau umrissenen Bevölkerungsgruppen stammen müssen. Die beteiligten Personen müssen zu Populationen gehören, die seit vielen Generationen den entsprechenden Infektionen ausgesetzt sind, es sollten möglichst auch Vertreter verschiedener Generationen einer Familie erfasst werden. Als Kontrollen werden DNA-Proben von Menschen eingesetzt, deren Bevölkerungsgruppe nicht oder nur selten der Infektion ausgesetzt waren und sind. Durch umfangreiche vergleichende Analysen sucht man anschließend (in äußerst umfangreichen Datensätzen!) nach Zusammenhängen zwischen von Infektion betroffenen Menschen und entsprechenden Auffälligkeiten in deren Genom im Vergleich zu Kontrollproben. Die Metapher von der Suche nach einer Nadel im Heuhaufen ist nur ein schwaches Bild für die Herausforderung dieser Aufgabe. Die technischen, bioinformatischen und strategischen Methoden werden jedoch fortwährend verbessert und ermöglichen Projekte dieser Art.
Hier sollen aktuelle Studien zu den beiden bedeutenden Infektionskrankheiten Malaria und Cholera vorgestellt und deren Einflüsse auf das Genom betroffener Menschen dargestellt werden. Anschließend werden verschiedene Auffassungen diskutiert, welche Bedeutung diese Auseinandersetzung zwischen Parasiten und Wirtsorganismen für evolutionäre Entwicklungen haben.
|
Das Projekt zur Entschlüsselung des menschlichen Erbguts ist seit 2004 abgeschlossen und mit neuen Schwerpunkten in verschiedenen Folgeprojekten weitergeführt worden. Durch die weiterentwickelten Sequenzierungsmethoden sind heute viele Humangenome komplett oder teilweise analysiert und in Datenbanken abgelegt. Die erweiterten Kenntnisse haben auch die Vorstellungen des Erbguts verändert. Dynamische Aspekte bei der Nutzung der Erbinformation in Zellen und Modifikationen am Genom durch verschiedenste Wechselwirkungen des Organismus mit seiner Umgebung hinterlassen Spuren im Erbgut.
Malaria und Cholera sind zwei Infektionskrankheiten, die in bestimmten geographischen Gebieten die dort lebenden Menschen seit vielen Generationen belasten. Die massiven Auswirkungen der Krankheiten üben einen starken Selektionsdruck aus. Schon lange ist bekannt, dass sich Phänomene wie z. B. die Sichelzellanämie im Zusammenhang mit Malaria in betroffenen Bevölkerungsgruppen etablieren. Trotz der gesundheitlichen Einschränkung für die betroffenen Menschen durch die Blutarmut verstärkt sie die Widerstandskraft gegen Malaria. Durch umfangreiche Studien an Menschen aus betroffenen Bevölkerungsgruppen sind verschiedene genetische Veränderungen bekannt, die im Zusammenhang mit den Infektionskrankheiten stehen. In verschiedenen Veröffentlichungen wird darüber diskutiert, wie weitreichend der Einfluss des Selektionsdrucks auf das Genom ist und inwieweit unter dem Einfluss von Infektionskrankheiten neue genetische Information generiert werden kann.
Nach bisherigen Kenntnissen sind die Auswirkungen der genetischen Veränderungen, die unter dem Selektionsdruck der Infektionskrankheit etabliert wurden, begrenzt. Sie reduzieren die Vitalität der betroffenen Menschen im Vergleich zu gesunden und verbessern nur die Situation von Erkrankten im Vergleich zu denen ohne die entsprechende genetische Veränderung.
|
|
|
Malaria
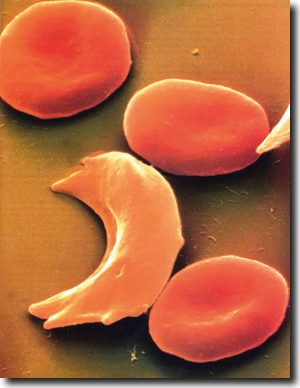 |
| Abb. 1: Normale und Sichelzellform von Roten Blutkörperchen (Erythrozyten). (University of Michigan Health System) |
|
In einem Übersichtsartikel stellt der renommierte Kinderarzt und Erforscher von Malaria, Dominik Kwiatkowski (2005) fest, dass Malaria nicht nur jährlich allein in Afrika den Tod von mehr als einer Million Kinder verursacht; die Infektionskrankheit übt darüber hinaus auch den stärksten Selektionsdruck auf das menschliche Genom in der jüngeren Geschichte aus. Nachfolgend wird eine Auswahl von genetischen Veränderungen vorgestellt, die die Funktionsfähigkeit von roten Blutkörperchen (Erythrozyten) beeinträchtigen, aber gleichzeitig einen Schutz vor schweren Verlaufsformen von Malaria bieten können. Das bekannteste Phänomen in diesem Zusammenhang ist die Sichelzell-Krankheit. Eine Mutation verändert den roten Blutfarbstoff Hämoglobin (s. u.). Für diesen Blutfarbstoff gibt es aber zwei Gene, eines vom Vater und eines von der Mutter. Ist nur ein Gen verändert so schützt diese Mischung von unverändertem und verändertem Hämoglobin vor massiven Auswirkungen von Malaria. Sind aber beide Gene mutiert, so werden die Eigenschaften der Erythrozyten so verändert, dass diese unter Sauerstoffmangel ihre Form in eine Sichelform (Abb. 1) ändern und sich zusammenlagern (aggregieren). Dadurch können kleine Arterien verschlossen werden, was vielfältige Krankheitserscheinungen auslösen kann. Reinerbige Menschen sterben unbehandelt in der Regel bis zum 30. Lebensjahr an der Sichelzellanämie.
 |
| Abb. 2: Schematische Darstellung von Hämoglobin mit und ohne gebundene Sauerstoffmoleküle (O2) sowie der Aggregation von Hämoglobin bei Sichelzell-anämie. H-Ionen begünstigen die O2 Abgabe und die veränderten b-Ketten können sich verbinden. Es kommt zur Ausbildung von sichelförmigen Erythrozyten. (Nach einer Grafik aus Wikipedia) |
|
Die veränderte Form der Blutkörperchen ist wie gesagt auf eine Modifikation des roten Blutfarbstoffs Hämoglobin zurückzuführen, der an Aufnahme, Transport und Austausch von Sauerstoff durch das Blut maßgeblich beteiligt ist (vgl. Abb. 2). Hämoglobin ist ein Proteinkomplex, der aus 4 Proteinen (2a- und 2b-Untereinheiten) zusammengesetzt ist. Betrachtet man den genetischen Hintergrund, so führt eine einzige Punktmutation (Austausch eines Nukleotids in der DNA-Sequenz auf Chromosom 11) an der Position 6 der Eiweißkette des b-Hämoglobins zum Austausch der Aminosäure Glutaminsäure gegen Valin (kurz: Glu6Val) (Abb. 3). Neben dieser genetischen Veränderung, die auch als single nucleotide polymorphism (SNP; dabei handelt es sich sozusagen um eine etablierte Punktmutation) bezeichnet wird, sind weitere modifizierte DNA-Sequenzen bekannt, die Eigenschaften von Erythrozyten verändern und im Zusammenhang mit Selektion durch Malaria stehen. Dazu zählt z. B. ein SNP, der auf den Austausch von Glutaminsäure an der Position 6 im β-Hämoglobin durch Lysin (Glu6Lys) zurückgeht und zu einer Hämoglobinvariante führt, die man als Hämoglobin C bezeichnet. Einer anderen Variante, Hämoglobin E, liegt der Austausch Glu26Lys zugrunde. Weitere Genveränderungen beeinflussen z. B. die Regulierung der Herstellung von α- und β-Hämoglobin und verursachen dadurch Thalassämien. Dabei handelt es sich um Krankheitsbilder, die erstmals im Mittelmeergebiet (thalassa, gr.: Meer) beschrieben wurden und durch unzureichende Mengen an funktionsfähigem Hämoglobin zu „Blutarmut“ (Anämie) führen.
Neben den bekannten sichelförmigen Erythrozyten sind weitere vererbbare pathologische Veränderungen bekannt, wie z. B. die Ovalozytose, die durch elliptische Erscheinung der roten Blutkörperchen gekennzeichnet ist. Ursächlich dafür ist eine Änderung am Strukturprotein SLC4A1; die Erythrozyten sind dadurch in ihrer Funktion stark eingeschränkt. Die zugrundeliegende genetische Veränderung ist vor allem in Bevölkerungsgruppen in Südostasien verbreitet. Um oxidativem Stress – ein weiteres Phänomen, dem Erythrozyten bei einer Malariainfektion verstärkt ausgesetzt sind – entgegenzuwirken, nutzen die Zellen das Enzym Glukose-6-phosphat-Dehydrogenase. Dieses wird vom Gen G6PD auf dem X-Chromosom codiert. Es sind viele verschiedene Variationen am G6PD-Gen bekannt und diejenigen, welche die Enzymaktivität beeinträchtigen, führen durch Hämolyse (Auflösung der Erythrozyten) zu Anämien.
 |
| Abb. 3: Eine einzige Punktmutation an der Position sechs der b-Protein-Untereinheit des Hämoglobins führt zur Sichelzellanämie. Dadurch wird die Aminosäure Glutaminsäure (Glu) durch Valin (Val) ersetzt – mit fatalen Folgen. |
|
Die beispielhaft und bei weitem nicht vollständig angeführten genetischen Veränderungen und die dadurch ausgelösten Phänomene stellen pathologische Veränderungen dar, die jedoch gleichzeitig zu Resistenzen gegenüber Malaria führen. Dieser Zusammenhang soll am Beispiel der Sichelzellkrankheit in Populationen, die unter starkem Selektionsdruck durch massive Malariainfektion ausgesetzt sind, kurz dargestellt werden.
Das Allel (Genvariante), das die Sichelzellkrankheit verursacht, ist in solchen Bevölkerungsgruppen auffällig stark verbreitet, die massiv Malariainfektionen ausgesetzt sind. Menschen, die die genetische Modifikation für Sichelzellen homozygot (also sowohl vom Vater als auch von der Mutter) ererbt haben, leiden unter schweren Verlaufsformen der Krankheit. Sie zeigen massive Krankheitserscheinungen und haben eine sehr geringe Lebenserwartung. Heterozygote Träger der Mutation für Sichelzellanämie (Glu6Val) besitzen neben dem defekten ein funktionsfähiges Gen; sie leiden damit zwar unter Anämie, sind aber gegen die massiven pathologischen Folgen von Malaria geschützt. Diese Befunde werden als Beleg für einen ausgesprochen starken Selektionsdruck durch Malaria angesehen. Kwiatkowski (2005) fasst „evolutionäre Selektion“ durch Malaria entsprechend unter den beiden folgenden Aspekten zusammen:
- Hoher Selektionsdruck auf Verlust des Sichelzellen-Gens aufgrund der tödlichen Konsequenzen für homozygote Träger der genetischen Modifikation für die Sichelzellkrankheit.
- Die oben beschriebenen Veränderungen im Genom haben sich in verschiedenen Bevölkerungsgruppen als unterschiedliche Antworten auf die Konfrontation mit Infektion durch Malaria-Erreger etabliert.
In einer genomweiten Assoziationsstudie1 (genome wide association study; GWAS) an aus Afrika stammenden Amerikanern bestätigen Ding et al. (2013) die bereits beschriebenen (und von Kwiatkowski [2005] zusammengefassten) Befunde für diesen Personenkreis. Genetische Varianten, die Resistenz gegen Malaria verleihen, stehen in Verbindung mit Merkmalen der roten Blutkörperchen. In einer früheren Studie an aus Europa stammenden Amerikanern waren ebenfalls genetische Varianten untersucht worden, bei denen ein Austausch einzelner Nukleotide (SNPs) stattgefunden hatte, wodurch die Eigenschaften der roten Blutkörperchen verändert worden waren. Von 15 entsprechend veränderten Positionen in Genomen von Europa-Amerikanern konnten bisher nur zwei in Afrika-Amerikanern nachgewiesen werden. In der Diskussion wird in diesem Zusammenhang auch darauf hingewiesen, dass die Ergebnisse von der gewählten Statistik abhängen. Dies unterstreicht, dass Genomstudien dieser Art in ihren Aussagen sehr differenziert bewertet werden müssen. Ding et al. stellen am Ende ihrer Publikation die Vermutung an, diese Differenzen zwischen den beiden ethnischen Gruppen könnten zumindest teilweise auch in den Unterschieden in der genetischen Architektur begründet sein, die den Merkmalen der Erythrozyten zugrunde liegt.
Die Infektionskrankheit Malaria und das damit in Verbindung stehende Phänomen der Sichelzellanämie gehören zu den klassischen Lehrbuchbeispielen für den Einfluss von Selektionsprozessen. Die heute verfügbaren Methoden zur schnellen und hochauflösenden Genomanalyse bestätigen den Einfluss von Selektion. Die bisher verfügbaren Daten zeigen verschiedene genetische Modifikationen, die den bekannten pathologischen Veränderungen zugrunde liegen. Aus den entsprechenden Studien geht gleichzeitig aber auch hervor, dass unser begrenztes Wissen über die Organisation und Funktion des menschlichen Genoms unserem Verständnis für die zugrundeliegenden Prozesse Grenzen setzt.
|
|
Cholera
Ähnlich wie Malaria ist auch Cholera eine bakterielle Infektionskrankheit (ausgelöst von Vibrio cholerae), die in betroffenen Bevölkerungsgruppen viele Todesopfer fordert. Als Ursprungsort gilt das Ganges-Delta, und die Bevölkerung in Bangladesch ist bis heute massiv von Cholerainfektionen betroffen.
Die Cholera auslösenden Bakterien kommen auch in anderen Lebensräumen vor und leben dort z. T. symbiotisch mit anderen Organismen zusammen, ohne Krankheiten zu verursachen. Francis & Wood (2009) haben Beispiele zusammengestellt und diskutieren diese im Zusammenhang mit der Entstehung der Cholera-Erkrankungen.
 |
| Abb. 4: Cholera-Patienten in Bangladesch. Foto: Ärzte ohne Grenzen. |
|
In Verbindung mit Cholera gibt es ebenso wie im Fall von Malaria Hinweise auf einen hohen Selektionsdruck auf das Genom in Bevölkerungsgruppen, die der Infektion schon lange ausgesetzt sind. So kommt die Blutgruppe 0, die im Zusammenhang mit erhöhtem Risiko für schwere Choleraerkrankung steht, in der Bevölkerung des Ganges-Deltas weltweit am seltensten vor.
V. cholerae-Bakterien, die typischerweise aus verunreinigtem Wasser stammen, siedeln sich im Dünndarm an, bilden das Choleratoxin und lösen durch Beeinflussung der in die Membran integrierten Chloridkanäle die Ausschüttung von Chlorid aus. Dies wiederum hat extremen Durchfall zur Folge mit entsprechend massivem Flüssigkeitsverlust und Elektrolytmangel, was u. U. zum Tode führen kann.
Karlsson et al. (2013) haben eine Methode entwickelt, die sie zur Untersuchung von genetischen Faktoren anwenden, die im Zusammenhang mit der Anfälligkeit für Cholerainfektion sowie der damit verbundenen Selektion stehen. Die Autoren fanden 305 Bereiche im menschlichen Genom, die sich zu einem großen Teil in der Nähe von Genen für die Kalium-Kanäle befinden, und solche, die im Zusammenhang mit dem angeborenen Immunsystem stehen. Über die Kalium-Kanäle erfolgt auch die Steuerung der Ausschüttung von Chlorid-Ionen. Genetische Veränderungen mit Einfluss auf die Kalium-Kanäle wirken sich auch auf den Elektrolythaushalt aus, was im Zusammenhang mit Cholera von besonderer Bedeutung ist.
Karlsson et al. zeigen durch Untersuchungen an zwei Bevölkerungsgruppen, dass ein Teil der identifizierten Gene in Verbindung mit Cholerainfektionen stehen. Dazu hatten sie zunächst Allele bestimmter Gene in einer Bevölkerungsgruppe identifiziert und deren häufiges Auftreten in von Cholera betroffenen Familien gezeigt. Zur Überprüfung untersuchten sie eine zweite Personengruppe und fanden auch hier einen Teil der in der ersten Untersuchung identifizierten Allele. Die betreffenden Gene waren durch die Konfrontation der entsprechenden Träger mit den Cholera-Bakterien über viele Generationen hinweg einem starken Selektionsdruck ausgesetzt. Dies zeigt sich darin, dass bestimmte Allele dieser Gene in den Genomen von betroffenen Personen der Bevölkerungsgruppe häufig vorkommen.
Derselbe Befund zeigt sich auch bei Genen, die an der Aktivierung des Inflammasoms, einem Proteinkomplex z. B. in Fresszellen (Makrophagen), beteiligt sind. Auch von diesen sind bestimmte Allele nach dieser Studie durch die Konfrontation mit den Cholera auslösenden Bakterien über viele Generationen in den Genomen auffällig häufig vorhanden, was durch die Selektion verursacht wird.
Karlsson et al. nutzten für ihre Studie den Umstand, dass bestimmte Bevölkerungsgruppen über viele Generationen hinweg durch Cholerainfektionen starker Selektion ausgesetzt waren. Diese haben nachhaltige Spuren im Genom der betroffenen Menschen hinterlassen. Dies ist daran erkennbar, dass bestimmte Bereiche im Genom die Anfälligkeit für die Cholera beeinflussen.
 |
| Die in der Auseinandersetzung mit Infek-tionen durch Selektion hervorgerufenen Veränderungen im menschlichen Genom scheinen begrenzt zu sein. |
 |
|
Die meisten der nachgewiesenen selektierten Gene codieren für Komponenten, die eher eine regulierende Funktion ausüben und weniger direkt beteiligte Schlüsselkomponenten. Aufgrund dieser Befunde stellen Karlsson et al. die Hypothese auf, dass die Selektion hier auf die Regulation von beteiligten Mechanismen und nicht auf einzelne Schlüsselbausteine wirkt.
Über Abwehrmechanismen gegenüber Choleraerregern sowie deren genetischem Hintergrund ist weniger bekannt als im Falle von Malaria. Die damit verbundenen Phänomene sind im Vergleich zu sichelförmigen Erythrozyten weniger auffällig und markant. Wohingegen Sichelzellanämie als Reaktion auf Malaria schon lange bekannt und vergleichsweise einfach diagnostisch zu erfassen und damit intensiv untersucht ist.
|
|
Schlussfolgerungen und Diskussion
Insgesamt scheinen die im menschlichen Genom feststellbaren Veränderungen, die sich durch den Selektionsdruck in der Auseinandersetzung mit Infektionen angesichts der langen Zeit und Anzahl der betroffenen Generationen etabliert haben, begrenzt zu sein. Typischerweise führen die selektierten genetischen Veränderungen, die im Genom betroffener Wirtsorganismen unter dem Selektionsdruck durch die Parasiten etabliert wurden, zu einer verringerten Vitalität. Organismen mit derart verändertem Genom sind nur in der Konfrontation mit Parasiten im Vergleich zu infizierten Individuen ohne genetische Änderungen relativ besser gestellt.
J. S. B. Haldane hatte bereits 1949 die Vermutung geäußert, dass in der ausgeglichenen Verteilung verschiedener genetischer Ausprägungen (Polymorphismen), wie sie oben beschrieben wurden, die Ursache für das häufige Auftreten z. B. von Thalassämien liegen könnte. Er hatte argumentiert, dass Menschen, in denen die Anlage für solche Krankheiten im heterozygoten Zustand vorliegen, gegen andere bedeutende und gefährliche Krankheiten (wie Malaria) geschützt sind. Eine alte Idee, die nicht zuletzt auch durch die jüngsten Untersuchungen zum menschlichen Genom gestützt wird und sich bewährt.
Der Schutz gegen Malaria durch das heterozygote Vorkommen des Sichelzellen-Gens wird in vielen Lehrbüchern als Standardbeispiel für evolutive Prozesse durch Selektion angeführt. Dawkins (1991) bezeichnet die Wechselwirkung zwischen Erreger und Wirt als Wettrüsten („arms race“), in dessen Verlauf unter dem Einfluss von Selektion immer neue Strategien und Methoden zur Infektion bzw. zu deren Verhinderung entwickelt werden. Behe (2007) dagegen erkennt darin eher einen Grabenkrieg („trench warfare“). Er bestreitet, dass durch Vorgänge dieser Art neue Eigenschaften gebildet werden, was er in seinem Buch „The Edge of Evolution“ ausführlich begründet. Er verwendet diese Metapher, weil in diesem Konflikt zwischen Parasit und Wirt sozusagen eher Brücken gesprengt werden, um die Eroberung der Stadt durch den Feind zu verhindern, als dass neue strategische Waffen („arms“) erfunden würden.
Die heute verfügbaren Methoden, mit denen Veränderungen im Genom sehr vieler Individuen untersucht werden, die unter dem Selektionsdruck von Infektionen stehen, lassen hoffen, dass wir in naher Zukunft Erkenntnisse gewinnen, mit deren Hilfe eine Entscheidung für eine dieser beiden Sichtweisen besser begründet werden kann.
|
Anmerkung
1 Epidemologische Untersuchung, in der das gesamte Genom auf den Zusammenhang zwischen genetischen Variationen und einem bestimmten Phänomen (z. B. ein bestimmtes Krankheitsbild) durchsucht wird.
|
|
|
Literatur
- Behe M (2007)
- The Edge of Evolution. Free Press, New York.
- Dawkins R (1991)
- The blind watchmaker. Penguin, London.
- Ding K, de Andrade M et al. (2013)
- Genetic variants that confer restistance to malaria are associated with red blood cell traits in African Americans: an electronic medical record-based genome wide association study. G3:Genes, Genomes, Genetics doi: 10.1534/g3.113.006452
- Francis J & Wood TC (2009)
- Choleratoxin und der Ursprung der Cholera-Erkrankung. Stud. Int. J. 16, 88-99.
- Haldane JSB (1949)
- Disease and evolution. Ricerca Sci. Suppl. 19, 1-11. (zit. nach: http://laboratoriogene.info/Ciencia_Hoje/Disease_and_Evolution1.pdf)
- Karlsson EK, Harris JB et al. (2013)
- Natural selection in a Bangladeshi population from the cholera-endemic Ganges river delta. Sci. Transl. Med. doi: 10.1126/scitranslmed.3006338
- Kwiatkowski DP (2005)
- How malaria has affected the human genome and what human genetics can teach us about malaria. Am. J. Hum. Genet. 77, 171-192.
|
|  |
