|
Die Zellmembranen auf der Basis von Phospholipiden stellen für Zellen eine erstaunlich flexible und stabile Abgrenzung zur Umgebung dar. Um den Austausch von Stoffen und Signalen zwischen den Zellen und ihrer Umgebung zu gewährleisten, sind in die Lipiddoppelschichten Proteine und Proteinaggregate integriert, die als Kanäle oder Pumpen den Transport durch die Membran sicherstellen (Abb. 1).
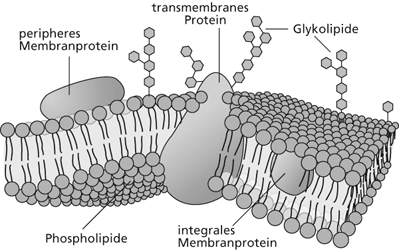 |
| Abb. 1: Stark vereinfachte schematische Darstellung einer Zellmembran. Die im Beitrag diskutierten Modellmembranen sind im Vergleich dazu sehr viel weniger komplex aufgebaut. |
|
In allen Modellen zur Lebensentstehung sind Etappen vorgesehen, in denen Membranen verschiedene Stoffe einschließen, die miteinander chemische Reaktionen eingehen können. Dass diese ersten zellähnlichen Gebilde eine Membran aufweisen, die in der Komplexität den heute bekannten Zellmembranen bereits ähnlich ist, ist aus evolutionstheoretischer Sicht wenig plausibel. Es werden also einfache Membranen gesucht, die sich schließlich zu heute bekannten Zellmembranen entwickelt haben könnten.
In Labors wurden verschiedene einfache Modelle für Zellen etabliert. In diesen konnten einzelne chemische Prozesse, die wir von heutigen Zellen kennen, demonstriert werden.1
Die Abgrenzung verschiedener, miteinander gekoppelter Synthesereaktionen gegen die Umgebung soll als Vorläufer für erste einfache Zellen vor allem das Verdünnungsproblem lösen. Wenn Substanzen erst einmal hergestellt worden sind, muss gewährleistet werden, dass sich diese nicht einfach durch Diffusion im gesamten verfügbaren Raum (Ursuppe, Tümpel, Ozean, ...) verteilen. Sie müssen in einem eng begrenzten Raum verbleiben, um dort für weitere Reaktionsschritte verfügbar zu sein. Ist ein bestimmter Reaktionsraum aber abgegrenzt, so ergibt sich ein Problem: wie können Komponenten, die zur längerfristigen Aufrechterhaltung der Synthesereaktionen benötigt werden, aus der Umgebung an den Ort der Reaktion gelangen?
Die Arbeitsgruppe von Jack Szostak hat bereits mehrere Beiträge über Modelle einfacher Zellen veröffentlicht. Aufgrund ihrer Erfahrung stellen Fettsäuren, deren entsprechende langkettigen Alkohole oder auch Fettsäuremonoester mit Glycerin geeignete Bausteine für erste Membranen dar. Diese amphiphilen2 Substanzen bilden Vesikel3 aus Lipiddoppelschichten, in die z.B. Oligonukleotide eingeschlossen werden und die durch Einbau weiterer Lipidmoleküle wachsen und sich teilen können. Oligonukleotide sind kurze Nukleinsäuremoleküle aus wenigen Bausteinen oder Nukleotiden. Mansy et al. (2008) berichten nun von Untersuchungen an Vesikeln aus Myristoleinsäure, einer langkettigen Carbonsäure mit 14 C-Atomen und einer Doppelbindung (14:1). Aufgrund der nach außen weisenden Carboxylatgruppen ist das Vesikel an seiner Oberfläche negativ geladen. Durch Zusätze von anderen Lipidkomponenten in die Membran untersuchten die Autoren deren Einfluss auf die Stabilität und Durchlässigkeit der Membran für Ribose – ein Kohlenhydrat, das als Baustein für Nukleinsäuren von großer Bedeutung ist. In einer vorausgegangenen Arbeit konnten Sacerdote & Szostak (2005) zeigen, dass Ribose im Vergleich zu Verbindungen mit ähnlicher Struktur bevorzugt durch Lipiddoppelschichten transportiert wird.
Die Durchlässigkeit von Lipiddoppelschichten aus Myristoleinsäure für Ribose steigt mit der Größe der hydrophilen Kopfgruppe und mit Verkürzung der Kettenlänge der Fettsäure. Eine Erhöhung der Anzahl an Doppelbindungen in der Fettsäurekette oder Verzweigungen führen ebenfalls zu einer höheren Durchlässigkeit.
 |
Bisher wurden noch keine ergiebigen
Synthesen für langkettige Fettsäuren
unter präbiotischen Bedingungen
vorgestellt – geht es mit kürzeren? |
 |
|
Aufgrund der Tatsache, dass bisher noch keine ergiebigen Synthesen für langkettige Fettsäuren unter präbiotischen Bedingungen vorgestellt worden sind, führten Mansy und Mitarbeiter die Versuche auch mit kürzeren und gesättigten Fettsäuren (ohne Doppelbindungen) durch. Mit Decansäure (10:0) kann man stabile Vesikel herstellen, allerdings erst bei hohen Konzentrationen (> 100 mM). Setzt man den entsprechenden Alkohol (Decanol) bzw. Glycerinmonoester zu, bilden sich bereits bei geringeren Konzentrationen stabile Vesikel. Die Autoren sehen in der Tatsache, dass sowohl die Stabilität als auch die Durchlässigkeit der Membranen bei Lipidmischungen im Vergleich zu den reinen Fettsäuren steigt, ein bemerkenswertes Argument zugunsten der Plausibilität des Modells für eine ungesteuerte Entstehung erster Zellen. Man benötigt keine reinen Ausgangskomponenten; die Vesikel könnten auch aus rohen Mischungen entstehen. Dabei ist jedoch zu beachten, dass bei ungesteuerten Synthesen nicht nur langkettige Moleküle (10 C-Atome), sondern auch viele weitere Komponenten erzeugt werden, von denen nicht erwartet werden kann, dass sie zur Stabilität der Vesikel beitragen; diese könnten auch die Bildung von Vesikeln beeinträchtigen oder verhindern. Die Erfahrung im Labor zeigt, dass Produktgemische nicht nur die Variationen im gewünschten Rahmen aufweisen.
Mansy et al. (2008) führten dann auch noch Experimente zur Durchlässigkeit von aktivierten Nukleotiden durch, und zwar für AMP, ADP und ATP (Adenosin-Mono-, Di-, und Triphosphat). Während für AMP und ADP in Gegenwart von Mg2+-Ionen (3 mM) geringe Durchlässigkeit nachgewiesen werden konnte, fanden die Autoren keine Durchlässigkeit ihrer Modellmembranen für ATP. Mansy et al. ziehen daraus den Schluss, dass Nukleotid-Triphosphate in dieser Phase der Lebensentstehung noch keine bedeutende Rolle gespielt haben.
Schließlich wurde in den Vesikeln noch Replikation (Verdopplung der DNA) modelliert. Dazu wurde DNA mit einem Einzelstrangteil aus 15 Cytidin-Nukleotiden (C) in Vesikel eingeschlossen. Dieser Einzelstrangbereich sollte durch aktivierte Guanosin-Nukleotide (G) komplettiert werden. Wenn aktiviertes G in das Medium zugegeben wurde, konnte nach 3 Stunden eine Replikationsreaktion nachgewiesen werden, nach ca. 24 Stunden war die Matrize aus 15 C weitgehend komplett mit G ergänzt. In Lösung (ohne Vesikel) ist diese Reaktion in ca. 6 Stunden komplett abgelaufen. Schließt man die Matrize in Vesikel aus Phospholipiden ein, so findet nach Zugabe von aktivierten Nukleotiden in die Lösung, in der sich die Vesikel befinden, in denselben keine Replikation statt.
Die Autoren diskutieren ihre Ergebnisse abschließend vor dem Hintergrund der Kontroverse um autotrophen oder heterotrophen Ursprung erster lebensähnlicher Systeme. Die Vertreter eines autotrophen Ursprungs des Lebens gehen davon aus, dass aus CO2 unter Nutzung von energieliefernden Reaktionen in Gegenwart entsprechender Katalysatoren einfache und später auch komplexere organische Substanzen synthetisiert worden sind und sich schließlich so etwas wie ein einfachster Stoffwechsel etablieren konnte. Nach heterotrophen Ursprungsvorstellungen ernährten sich die Vorläufer erster Zellen von komplexen und energiereichen organischen Substanzen, die irgendwo unter entsprechenden Bedingungen (Ursuppen oder ähnliches) entstanden sind. Aus Sicht von Mansy et al. (2008) stärken ihre Befunde die Position eines heterotrophen Lebensursprungs.4 Denn die von ihnen hergestellten Protozellen können keine autotrophen Systeme sein, da erste Syntheseprodukte durch die undichte Zellmembran entweichen und für weitere Schritte verloren sind. Dagegen erlauben die Modelle den Import benötigter Komponenten aufgrund der Durchlässigkeit der Membran. Den Autoren ist sicher zuzustimmen, wenn sie feststellen, dass beide Ursprungsvorstellungen noch zahlreiche konzeptionelle Schwierigkeiten hinsichtlich der Entstehung komplexer molekularer Bausteine überwinden müssen.
Aus der Sicht der Autoren unterstützen ihre Ergebnisse die Vorstellung, dass eine sehr einfache Protozelle in einer Umgebung, die mit komplexen Nährstoffen angereichert war, entstehen konnte. Dabei ist allerdings zu bedenken, dass weder die Lipide noch die aktivierten Nukleotide für die Replikation bisher unter Bedingungen hergestellt worden sind, die ohne gezielte Eingriffe von Experimentatoren auskommen; sie wurden also bisher nicht unter Bedingungen synthetisiert, die man als präbiotisch bezeichnen könnte. Das Modell von Mansy et al. funktioniert bisher im chemischen Labor, aber wie es ohne die Kompetenz von Chemikern – von alleine – funktionieren soll, ist aufgrund der Erfahrung nicht erkennbar.
|
