 |
Auf der Suche nach dem „Spiegel der Weisen“
von Peter Imming
Studium Integrale Journal
19. Jahrgang / Heft 2 - Oktober 2012
Seite 84 - 92
|
 |
Zusammenfassung: Kam das Leben aus dem All? Diese Annahme wird nicht nur im populären Sinne vermarktet, wie z. B. dass Außerirdische Lebenssamen auf die Erde getragen hätten. Sie wird seit Jahrzehnten immer wieder einmal – und aktuell verstärkt – für eines der größten Probleme eines naturalistischen Verständnisses der Lebensentstehung herangezogen. Geht das Vorkommen nur der L- bzw. D-Formen von Aminosäuren und Zuckern in Lebewesen darauf zurück, dass bestimmte Meteoriten einen kleinen Überschuss ähnlicher Moleküle auf die Erde brachten, der sich dann vermehrt hat?
|  |
|
Einleitung
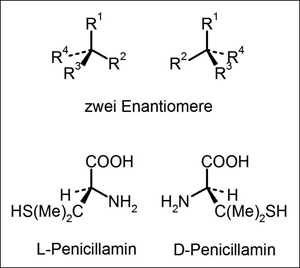 |
| Abb. 1: Zwei Enantiomere von Kohlenstoffverbindungen mit vier verschiedenen Resten (Substituenten) an einem zentralen Kohlenstoffatom; oben allgemein; unten ein konkretes Beispiel: die beiden Penicillamin-Enantiomere. Mit L bzw. D werden nach einer von Emil Fischer im 19. Jahrhundert vorgeschlagenen Nomenklatur Enantiomere unterschieden. Die Regeln für die Feststellung, ob ein Enantiomer L- oder D-konfiguriert ist, werden hier nicht erklärt. Me steht für Methyl-Gruppen. Die keilförmigen bzw. strichlierten Linien zeigen an, ob ein Rest vor bzw. hinter der Zeichenebene steht. |
|
Im Dezember 2010 erschien in der Zeitschrift Quarterly Review of Biology eine umfassende Literaturübersicht von Michael J. Behe über experimentelle Evolution unter dem Titel „Experimental evolution, loss-of-function mutations, and the first rule of adaptive evolution“ (Experimentelle Evolution, Funktionsverlust-Mutationen und die erste Regel der adaptiven Evolution). Diese Arbeit hat eine heftige Diskussion entfacht und wurde von Freund und Feind als bedeutender Beitrag und als ein gründliches Stück Arbeit gewürdigt. Behes Überblicksarbeit soll einen Beitrag zum Verständnis der genetischen Basis von evolutionären Adaptionen (Anpassungen) liefern, die in Laborexperimenten erzeugt wurden. In diesem Artikel soll ein kurzer Überblick über Behes Arbeit und über die dadurch ausgelöste Diskussion erfolgen.
Michael Behe, Jahrgang 1952, arbeitet als Professor für Biochemie an der Lehigh Universität, einer privaten Forschungsuniversität in Pennsylvania (USA). Er gilt als Vertreter des „Intelligent Design“ und hat das Konzept der nichtreduzierbaren Komplexität in seinem berühmten Buch „Darwins Black Box“ (1996) bekannt gemacht. Behe ist außerdem Senior Fellow am Center for Science & Culture (CSC) des Discovery Instituts (www.discovery.org).
Die Zeitschrift Quarterly Review of Biology (QRB) ist seit 1926 eine führende Review-Fachzeitschrift (Zeitschrift mit Überblicksartikeln) und veröffentlicht Artikel auf allen Gebieten der Biologie, mit traditionellem Schwerpunkt auf Evolution, Ökologie und Biochemie. QRB bringt aber nicht nur Zusammenfassungen einer Thematik, sondern stellt auch wichtige neuere Ideen, Konzepte und Synthesen vor.
|
|
|
Enantiomerenüberschüsse im Murchison- und anderen Meteoriten
Breslows Ausgangspunkt sind Untersuchungen am Murchison-, Murray- und Orgueil-Meteoriten (Pizzarello & Groy 2011). Der bekannteste von ihnen ist der Murchison-Meteorit (Abb. 4). Er ging 1969 in der Nähe der gleichnamigen Stadt in Australien nieder. Die zahlreichen Bruchstücke wogen insgesamt über 100 kg. Er wird zur Klasse der kohligen Chondrite gezählt, die bis zu 3% Kohlenstoff als Graphit, Carbonat und organische Verbindungen enthalten. Im Murchison-Meteoriten wurden viele verschiedene organische Substanzen nachgewiesen, die offensichtlich sowohl Weltraumkälte als auch die an der Oberfläche auftretende Hitze beim Eindringen in die Erdatmosphäre überstanden. Das Innere größerer Stücke des Meteoriten war bei ihrer Auffindung und nach dem Aufbrechen immer noch mehr als eiskalt.
|
Chiralität (Händigkeit, Spiegelbildlichkeit) ist konstitutive molekulare Eigenschaft aller uns bekannten Lebewesen. Dank ihres Stoffwechsels inklusive entsprechender chiraler und chiralitätserhaltender Enzyme produzieren Lebewesen immer wieder genau das eine, richtige, physiologisch benötigte Enantiomer*. Wie kam es zu dieser natürlichen Homochiralität*? Aktuell erschien dazu ein Artikel des berühmten Chemikers Ronald Breslow im Journal of the American Chemical Society, einem der höchstrangigen chemischen Fachblätter der Welt (Breslow 2012). Breslow fasst darin einige von ihm in den letzten Jahren publizierte Untersuchungen und Gedanken zusammen. Es geht um die proteinogenen* Aminosäuren, aus denen die Proteine (Eiweiße) von Lebewesen aufgebaut sind. Im Murchison- und anderen relativ kohlenstoffreichen Meteoriten sind für einige nicht-proteinogene alpha-Methylaminosäuren kleine Enantiomerenüberschüsse gefunden worden; die meisten Aminosäuren lagen als Racemate* vor. Der Grund für die Enantiomerenüberschüsse ist nicht bekannt. Diskutiert wird eine Zersetzung durch circular polarisiertes Licht, die eines der Enantiomere weniger stark als das andere betroffen hätte. Circular polarisiertes Licht ist im Weltraum bisher nicht nachgewiesen worden, vor allem müsste angenommen werden, dass nur links, nicht rechts polarisiertes Licht einwirkte, was nicht begründbar ist.
Der Enantiomerenüberschuss der nicht-proteinogenen alpha-Methylaminosäuren habe sich dann durch eine Reaktionskette mit Iminbildung, Kupferionen-katalysierte Decarboxylierung und Hydrolyse unter Beteiligung von alpha-Ketocarbonsäuren auf proteinogene alpha-Aminosäuren übertragen. Offen bleibt, wie sich die Spezifität und Selektivität dieser Reaktion in einem Freilandgeschehen mit vielen anderen reaktionsfähigen Molekülen herbeiführte, und wie der winzige, im kontrollierten Laborversuch durchaus erzielbare Enantiomerenüberschuss vor allgegenwärtigen Racemisierungsvorgängen geschützt wurde.
Für die Verstärkung eines Enantiomerenüberschusses der alpha-Aminosäuren wird fraktionierte Kristallisation* angenommen. Auch diese gelingt im kontrollierten Laborversuch; unerklärlich bleibt, wie die erforderlichen Bedingungen und Arbeitsschritte (keine störenden anderen Moleküle; Abtrennung der Fraktionen; Schutz der racemischen Gemische vor Racemisierung) von allein stattfinden konnten. Breslow erläutert abschließend, in einer chemischen Fachpublikation etwas überraschend, dass fortgeschrittene Versionen von Dinosauriern auf anderen Planeten mit D-Aminosäuren und L-Zuckern eine Gefahr für uns darstellten, würden wir ihnen begegnen. Die Annahme, dass fremde, größere Außerirdische für uns automatisch gefährlich sind, wird kommentiert.
|
 |
| Abb. 2: Das linke Foto zeigt den Autor dieses Beitrags vor einem Spiegel sitzend und eine Zeitschrift in der Hand haltend. Auf dem rechten Foto ist das Spiegelbild des Autors verschwunden. Jedem Betrachter ist klar: hier ist bewusst manipuliert worden. Die beiden Fotos sind als Veranschaulichung der Überraschung – und der naheliegenden Erklärung – gedacht, die das Fehlen der Spiegelbilder in der Natur beim Chemiker auslöst. |
|
Im jetzigen Zusammenhang interessiert, welche Aminosäuren der Meteorit enthielt. Insgesamt ist ihre Art und ihr Verhältnis zueinander als „exotisch“ (nicht-irdisch) beschrieben worden, da relativ hohe Anteile nicht-proteinogener Aminosäuren enthalten sind, aber typische Aminosäuren von Proteinen nicht oder fast nicht vorkommen (Engel et al. 1990). An proteinogenen Aminosäuren enthielt der Meteorit Glycin (für die Homochiralitätsfrage irrelevant, da nicht chiral) sowie Alanin, Valin, Asparaginsäure, Glutaminsäure, Prolin und Leucin – alle erwartungsgemäß als Racemate (1:1-Mischungen der Enantiomere). Frühere Arbeiten hatten für Alanin, Glutaminsäure, Asparaginsäure, Prolin und Leucin nicht-racemische Mengenverhältnisse zugunsten der L-Enantiomere gefunden (Engel et al. 1990, Engel & Nagy 1982, Pollock et al. 1975). Die unterschiedlichen Befunde – manchmal Racemate, manchmal kleiner L-Enantiomerenüberschuss – werden darauf zurückgeführt, dass in unterschiedlichen Bereichen der Bruchstücke unterschiedliche Enantiomerenverhältnisse vorliegen. Wie das kommt, weiß man nicht, da man ja auch den Grund für die Enantiomerenüberschüsse nicht kennt (s. u.). Daneben waren im Murchison- und auch im Murray- und Orgueil-Meteoriten Aminosäuren enthalten, die bisher in Lebewesen nicht gefunden wurden: 2-Amino-2,3-dimethylpentansäure (beide Diastereomere), Isovalin, alpha-Methylnorvalin, alpha-Methylvalin und alpha-Methylnorleucin (Pizzarello & Cronin 2000). Sie unterscheiden sich von den typischen proteinogenen Aminosäuren darin, dass sie am alpha-C-Atom, das die Amino- und die Carbonsäure-Gruppe trägt, neben dem für die jeweilige Aminosäure typischen dritten Substituent kein Wasserstoff-Atom, sondern eine Methylgruppe tragen (Abb. 3). Das führt auch zu Chiralität, aber die Mechanismen und Möglichkeiten einer Racemisierung sind andere als bei den proteinogenen Aminosäuren.
Insgesamt wiesen acht Aminosäuren und eine Hydroxysäure in manchen Proben einen kleinen Enantiomerenüberschuss (0 bis ca. 19%) zugunsten des L-Enantiomers auf (Übersichtsartikel: Pizzarello & Groy 2011). Das ist der Enantiomerentyp, der im Wesentlichen die Peptide und Proteine von Lebewesen konstituiert. Der Enantiomerenüberschuss schwankte z. T. sehr stark; für Isovalin betrug er in Bruchstücken des Murchison-Meteoriten zwischen 0 und 15% in Abhängigkeit davon, welches Bruchstück man untersuchte, und er schwankte auch innerhalb eines Bruchstücks über kleine Abstände hinweg (Pizzarello et al. 2003). Auch in einem hier nicht weiter behandelten Meteoriten, dem Bell-Meteoriten, wurde weder für Isovalin noch für die anderen darin nachgewiesenen nicht-proteinogenen Aminosäuren ein Enantiomerenüberschuss gefunden (Monroe & Pizzarello 2011).
Der erwähnte Fund eines Enantiomerenüberschusses ist bisher der einzige, der einem nicht biogenen Ursprung zugeschrieben wird (Pizzarello & Groy 2011). Wegen dieser Einmaligkeit wenden sich rein naturalistische Erklärungsmodelle für Homochiralität regelmäßig und wiederkehrend diesen Meteoritenfunden zu. |
|
Woher der Enantiomerenüberschuss?
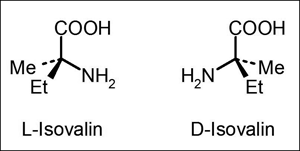 |
| Abb. 3: Isovalin (alpha-Amino-alpha-methylbuttersäure) als Beispiel für eine der alpha-Methylaminosäuren, die in den Meteoriten mit einem Überschuss zugunsten des L-Enantiomeren gefunden wurden. Insgesamt wurden in der geschätzten Gesamtmasse von 100 kg des Murchison-Meteoriten ca. 240 mg Isovalin gefunden. Der in einigen Proben maximal gefundene Enantiomerenüberschuss betrug 19%, d.h. die Probe bestand zu 59,5% aus L- und zu 40,5% aus D-Isovalin. Das entspricht einem meteoritischen Eintrag von absolut etwa 140 mg L- und 100 mg D-Isovalin auf die Erde. |
|
Woher kommen die Aminosäuren selbst, insbesondere in diesem Zusammenhang natürlich die alpha-Methylaminosäuren, und ihr Enantiomerenüberschuss?
(1) Sind es irdische Verunreinigungen? Das wird ausgeschlossen; denn die Aminosäuren haben einen hohen Anteil des Isotops 13C, typisch für organische Verbindungen aus dem All. Dahinter stehen Annahmen über die Entstehungsorte und -bedingungen von Asteroiden (Pizzarello 2007). Außerdem bilden die nachgewiesenen Aminosäuren Art und Mengenverhältnisse irdischer Aminosäuren nicht ab.
(2) Wie sind sie im Weltraum entstanden? Chemisch möglich und im Labor nachvollziehbar ist eine Strecker-Synthese aus Cyaniden, Aldehyden, Ketonen und anderen spektroskopisch im Weltraum nachgewiesenen Ausgangsmaterialien. Dann wären alle Aminosäuren zunächst als Racemate entstanden.
(3) Spätere Enantiomerenanreicherung durch fraktionierte Kristallisation* oder Sublimation konnte mindestens für Isovalin, die alpha-Methylaminosäure mit dem höchsten Enantiomerenüberschuss in Meteoriten, experimentell ausgeschlossen werden (Pizzarello & Groy 2011). Racemisches Isovalin kristallisiert aus Wasser in Form von Konglomeraten von Kristallen der D- und L-Enantiomere. Anders gesagt: Es liegen dann feste 1:1-Mischungen der Kristalle jedes Enantiomers vor. Somit führt dieser Kristallisationsschritt nicht zur Racemattrennung. Ein Enantiomerenüberschuss könnte sich also nur bilden, wenn sich die Enantiomere ineinander umwandeln (racemisieren) können, solange sie noch gelöst, nicht kristallisiert sind. Racemisierung ist bei alpha-Methylaminosäuren in Wasser aber nicht möglich. Der für Isovalin gefundene Kristallisationstyp spricht auch gegen eine Enantiomerenanreicherung durch Sublimation. Sublimation* wäre natürlich kosmochemisch auf oder in Meteoriten näherliegend gewesen als Kristallisation.
|
Ateleologisch: ohne Ziel und Zweck. Chiralität (Händigkeit) beschreibt das Phänomen, dass Objekte einschließlich Molekülen die Eingenschaft aufweisen können, nicht mit ihrem Spiegelbild kongruent zu sein. Nicht alle Objekte sind chiral. Mathematisch gesprochen müssen sie bestimmten Symmetriegruppen angehören, um chiral zu sein, was hier nicht ausgeführt werden kann. Diastereomere sind Moleküle, die sich nicht in der Verknüpfung der Atome miteinander unterscheiden, sondern in ihrer räumlichen Anordnung, und die keine Enantiomere sind. Enantiomere sind Moleküle, die Bild und Spiegelbild voneinander und nicht kongruent (deckungsgleich) sind. Enantiomerenüberschuss (engl. enantiomeric excess, daher die Abkürzung ee): Der Überschuss eines Enantiomers wird als Differenz der Anteile der beiden Enantiomere in Prozent ausgedrückt. Entstehen z. B. bei einer Reaktion die Enantiomere zu 98 und 2 Teilen, so entspricht das einem ee von 98-2=96%. Angegeben sein muss noch, welches der beiden Enantiomere im Überschuss vorliegt. Entstehen sie im Verhältnis 50:50, so ist der ee 0% und es liegt ein Racemat vor. Stereoselektive Reaktionen in Lebewesen verlaufen mit ee über 99%. Fraktionierte Kristallisation oder Sublimation: Stoffgemische lassen sich im Labor oft dadurch auftrennen, dass man die unterschiedliche Löslichkeit oder Sublimationsneigung der Bestandteile ausnutzt. Für Kristallisation: Man löst das Gemisch in einem durch Probieren gefundenen Lösungsmittel in der Wärme; beim Abkühlen fällt überwiegend die schlechtest lösliche Komponente aus und ist im Gemisch stärker angereichert als vor dem Kristallisationsschritt. Trennt man die ausgefallenen Kristalle von der Lösung und wiederholt den Vorgang, so reichert man diese Komponente schrittweise (fraktioniert) immer mehr an. Der Trennvorgang findet nur statt, wenn die angereicherte Fraktion abgetrennt wird, bevor der nächste Fraktionierungsschritt folgt. Homochiralität bedeutet, dass von zwei Enantiomeren nur eins vorliegt bzw. vorkommt. proteinogen: in Proteinen (Eiweißen) von Lebewesen vorkommend. Racemate sind Mischungen von Enantiomeren im Verhältnis 1:1. Wenn das Verhältnis der Enantiomere von 1:1 abweicht, ohne dass reine Enantiomere vorliegen, spricht man von racemischen Gemischen. Sublimation: Direkter Übergang vom festen in den gasförmigen Zustand oder umgekehrt, ohne zwischendurch flüssig zu werden. Substituenten sind Atome oder Atomgruppen, die an ein zentrales bzw. die molekulare Struktur definierendes Atom gebunden sind.
|
(4) Wieso sind nur die alpha-Methylaminosäuren, nicht die anderen auf dem Meteoriten gefundenen, in nicht vollständig racemischer Form nachgewiesen worden? Biogene Prozesse werden von keiner Seite angenommen, weil es nicht möglich scheint, dass Meteoriten oder Kometen auch nur bakterielles Leben zulassen.1 Man versucht, ein sogenanntes Szenario zu erdenken, also eine Abfolge mehrerer Spekulationen:
 |
| Abb. 4: Ein Bruchstück des 1969 in Australien niedergegangenen Murchison-Meteoriten. (Creative Commons Linzenz, © Art Bromage) |
|
(a) Aminosäuren können durch circular polarisiertes Licht zerstört werden, und zwar die D-Formen schneller als die L-Formen, wenn man rechts circular polarisiertes Licht des ultravioletten Bereichs verwendet, wie schon vor längerer Zeit experimentell gezeigt wurde (Flores et al. 1977). Allerdings kann das Licht in der hierfür benötigten Intensität die Erdatmosphäre nicht durchdringen, und wir wissen nicht, ob es im All „vorkommt“. Man spekuliert, Neutronensterne oder magnetische Zwergsterne könnten es erzeugen. Einen astronomischen Beweis für circular polarisiertes Licht gibt es nicht (Pizzarello & Groy 2011). Wenn es vorkommt, dann in beiden spiegelbildlichen Formen (also sowohl rechts als auch links circular polarisiert). Das eine würde die L-, das andere die D-Aminosäuren schneller zersetzen. Eine Aussage wie „Dann ist es eben zufällig an einer Stelle vor allem in der einen Weise geschehen“ verlässt den Erklärungsrahmen, der üblicherweise angenommen wird, da ja naturgesetzliche, nicht „rein zufällige“ Erklärungen gesucht werden. Außerdem lassen die großen Zahlen an Einzelmolekülen, mit denen man es chemisch immer zu tun hat, solche stochastischen Erklärungsversuche kaum zu. Chemisch stellt sich weiterhin die Frage, ob die genannten Sterntypen organische Moleküle in ihrer Nähe nicht komplett zerstören würden, und wie Meteoriten ihre eventuelle kostbare Fracht von dort bis zur Erde bringen konnten. Außerdem wurde schon vor einigen Jahren darauf hingewiesen, dass der gefundene Enantiomerenüberschuss von bis zu 19% für Isovalin höher ist, als er theoretisch sein dürfte, wenn er auf Zerstörung durch circular polarisiertes Licht zurückginge. Es bedarf verschiedener, teilweise aufeinander aufbauender Hilfsspekulationen, die gerne „Möglichkeiten“ genannt werden, um dieses Detail wegzudiskutieren (Pizzarello 2007), die wegen ihrer fehlenden experimentellen Begründung hier nicht referiert werden sollen.
(b) Natürlich ist die Entstehung von Biomolekülen nicht als einfacher Prozess anzunehmen, und es ist wissenschaftlich reizvoll, chemisch-physikalisch gangbare Wege zu ersinnen und experimentell zu testen. Diese Szenarien postulieren bzw. benötigen aber regelmäßig erstens das Zusammentreffen ausgewählter Reaktionspartner. Zweitens bedürfen sie einer vom „gewünschten“ Ergebnis bestimmten Reaktionsabfolge unter Ausblendung anderer Reaktionspartner und -prozesse, die zu ganz anderen Produkten führen würden. Man selektiert also gedanklich Ausgangsstoffe, Reaktionen und Produkte, ohne auch nur ansatzweise plausibel machen zu können, wie das Ganze unter natürlichen Verhältnissen ohne genau diese Selektion zum selben Ergebnis hätte führen können.
 |
| Kann ein Golfball einen 18-Loch-Kurs erfolgreich ohne einen Golfer allein unter der Einwirkung natürlicher Kräfte absolvieren? |
 |
|
Dieses Grundproblem der Szenarien für Lebens- und Homochiralitätsentstehung wurde auch von naturalistischer Seite aufgezeigt. So illustrierte Robert Shapiro anschaulich: „Das zentrale Problem lässt sich anhand einer Analogie erläutern: Nachdem ein Golfer einen 18-Loch-Kurs erfolgreich absolviert hat, behauptet er, der Ball hätte das auch ohne ihn schaffen können – unter der Einwirkung natürlicher Kräfte wie Erdbeben, Stürmen, Regengüssen und so weiter –,wenn man ihm nur genügend Zeit gelassen hätte. Ähnlich wie in diesem Vergleich widerspräche die spontane Entstehung von RNA [sein Beispiel: Entstehung von Replikatoren] keinem Naturgesetz; nur wäre sie extrem unwahrscheinlich gewesen“ (Shapiro 2007). Der wohl bedeutendste Lebensentstehungstheoretiker des 20. Jahrhunderts, Leslie Orgel, schrieb: „Es ist nicht vollkommen unmöglich, dass ausreichend spezifische mineralische Katalysatoren für jede einzelne Reaktion des reversen Citrat-Zyklus existieren [sein Beispiel für autokatalytische präbiotische Reaktionszyklen]. Aber die Möglichkeit, dass ein kompletter Satz solcher Katalysatoren gemeinsam an einer Stelle der ursprünglichen Erde vorkam ohne das gleichzeitige Vorkommen von Katalysatoren, die den Zyklus zerstören, scheint extrem weit hergeholt zu sein. Mangelnde Spezifität, nicht unzureichende Effizienz dürfte das Haupthindernis für die Existenz komplexer autokatalytischer Zyklen fast jeder Art sein.“ (Orgel 2008; Übersetzung: P. I.)
(c) Für die nicht-proteinogenen alpha-Methylaminosäuren in den Meteoriten wird also angenommen, dass der Enantiomerenüberschuss auf Zersetzung vor allem der D-Enantiomere zurückgeht. Warum sind dann aber die proteinogenen Aminosäuren als Vollracemate enthalten? Vermutung: Sie wurden zwar ebenfalls partiell zersetzt. Danach trat aber wieder Racemisierung auf dem bekannten Weg der Deprotonierung/Protonierung am alpha-C-Atom ein. Letzterer Prozess kann bei den alpha-Methylaminosäuren nicht stattfinden.
Eine naturalistische, ateleologische Erklärung für die Enantiomerenüberschüsse einiger weniger Aminosäuren in einigen wenigen Bruchstücken bestimmter Meteoriten existiert also nicht.
|
|
Übertragung des Enantiomerenüberschusses?
Breslow (2010; 2012), Pizzarello (2006) und andere schließen einen kleinen chemischen Schritt an, der viel voraussetzt und sehr viel bewirkt haben soll. Der Grundgedanke ist, dass ein Enantiomerenüberschuss bei einem bestimmten Molekül durch chemische Reaktionen auf eine Aminosäure übertragen werden könnte.
Es ist sehr lange bekannt, dass Aminosäuren mit alpha-Ketocarbonsäuren zu Iminen reagieren, die decarboxylieren können (Abb. 5). Diese Abspaltung von Kohlendioxid wird durch Wärmeeinwirkung, Enzyme oder Metallionen beschleunigt. Bei Verwendung von Kupfer(Cu2+)-Ionen konnten Breslow und Mitarbeiter beispielsweise aus enantiomerenreinem L-alpha-Methylvalin (also 100% Enantiomerenüberschuss) und Natriumphenylpyruvat (achiral) nach Decarboxylierung und Hydrolyse des intermediären Imins die proteinogene Aminosäure Phenylalanin mit einem Enantiomerenüberschuss von 37% zugunsten der L-Form sowie achirales 3-Methylbutanon erzeugen (Chruma et al. 2005).
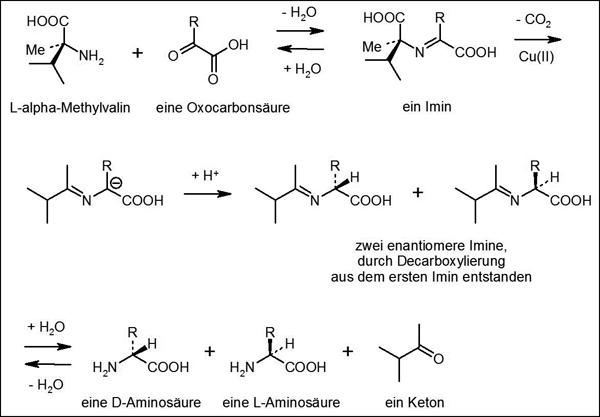 |
| Abb. 5: Postulierte Übertragung des Enantiomerenüberschusses einer alpha-Methylaminosäure – hier: L-alpha-Methylvalin. Im ersten Schritt wird Wasser abgespalten und es bildet sich ein Imin. Es decarboxyliert (– CO2) zu einem Iminanion; dabei geht das Chiralitätszentrum der alpha-Methylaminosäure verloren. Das Proton (H+) kann von oben oder unten angelagert werden, so dass prinzipiell beide Enantiomere des nächsten Imins entstehen können. Bei Gegenwart einer geeigneten Konzentration von Kupferionen und Abwesenheit vieler anderer möglicher Reaktionspartner können Decarboxylierung und Protonierung so stattfinden, dass eins der beiden decarboxylierten enantiomeren Imine im Überschuss entsteht. Die nachfolgende Hydrolyse durch Wasser würde dann zu einem Überschuss einer der beiden enantiomeren Aminosäuren führen. |
|
Mit dieser Reaktion wird also gezeigt, wie der Enantiomerenüberschuss der alpha-Methylaminosäuren von Meteoriten teilweise auf Aminosäuren übertragen werden könnte, die in Lebewesen konstituierend vorkommen. Auch für diesen Prozess gibt es Einwände, die dem Laien vielleicht unbedeutend erscheinen, aus chemischer Sicht aber sehr schwerwiegend sind:
(1) Schon Zn2+-Ionen als Katalysatoren vermögen den Enantiomerenüberschuss nicht „mitzunehmen“. Sie katalysieren zwar den Decarboxylierungsprozess, aber die 100% Enantiomerenüberschuss werden dabei zu 0%. Im Murchison-Meteoriten wurden laut neuesten Analysen ca. 2400 ppb Isovalin (Abb. 2) gefunden; die anderen alpha-Methylaminosäuren waren in noch wesentlich geringerer Menge enthalten (Glavin & Dworkin 2009). Bei 100 kg Meteoriten-Masse entsprechen 2400 ppb ca. 0,24 g dieser Aminosäure. Eine frühere Analyse fand aus dem Inneren eines Murchison-Bruchstücks 7,5 nmol/g Isovalin; bei einer Molmasse von 117,15 berechnet man 0,09 g in 100 kg (Engel et al. 1990). Sie hatte einen Enantiomerenüberschuss von 0-19%, je nach Meteoriten-Bruchstück und Lokalisation im Bruchstück (Pizzarello et al. 2003). Wenn nur Cu-Ionen (unmöglich, da andere salz- und komplexbildende Kationen ebenfalls vorhanden waren) die Reaktion mit nur alpha-Ketocarbonsäuren herbeiführten (wiederum unmöglich, da es auf einer präbiotischen Erde auch viele andere Reaktionspartner gab), dann ist vielleicht ein Enantiomerenüberschuss von 0-3% erreichbar. Breslow selbst (Breslow 2012) erwartet 1% Enantiomerenüberschuss. Dieser Überschuss ist noch geringer, da er sich auf mehrere bis viele alpha-Aminosäuren verteilt, weil nicht auch noch vorausgesetzt werden soll, dass Isovalin immer mit derselben alpha-Ketocarbonsäure reagierte.
(2) Diese winzigen Mengen winziger Enantiomerenüberschüsse wären auch unter präbiotischen Verhältnissen schnell den üblichen Racemisierungsprozessen zum Opfer gefallen, die ja schon dazu geführt haben sollen, dass Alanin, Valin und andere proteinogene Aminosäuren in den Meteoriten trotz vorangegangener partiell enantioselektiver Zersetzung als Racemate vorliegen (s. o.). Das Problem, wie kleine Überschüsse eines Enantiomeren „überleben“ sollen, ist von chemischer Seite schon vor langem klar formuliert worden; denn es basiert auf einer Grundeigenschaft vieler Enantiomere: „Jedes geringfügige Vorherrschen von D- oder L-Formen bei präbiotischen Prozessen würde in einer geologischen Umgebung durch Racemisierungsreaktionen wieder aufgehoben werden“ (Dose 1987).
Kohlenstoffverbindungen können unterschiedlich leicht racemisieren. Je leichter eine der vier Gruppen bzw. Atome vom Asymmetriezentrum abgelöst und wieder angefügt werden kann, desto leichter passiert es. Lediglich die Ablösung einer der Gruppen mit irgendwelchen Folgereaktionen führt nicht zu einer Racemisierung, sondern zur Zersetzung der Kohlenstoffverbindung an dieser Stelle, was automatisch mit dem Verlust der chiralen Information einhergeht. Insbesondere oxidative Prozesse führen diesen Verlust von Asymmetriezentren herbei. Racemisierungen finden unter den folgenden Voraussetzungen vergleichsweise leicht statt, und zwar sowohl unter Labor- als auch unter Freilandbedingungen:
(a) Wenn ein asymmetrisch substituiertes Kohlenstoffatom ein H-Atom trägt, das als Proton (H+ abgespalten werden kann. Dafür muss die C-H-Bindung entsprechend polarisiert sein, beispielsweise durch benachbarte Carboxyl-Gruppen wie in Peptiden und Proteinen. Als Hilfsmittel wird etwas (schwache) Base benötigt. Das könnte in der Natur Carbonat oder ein (biogenes) Amin sein. Damit es zur Racemisierung kommt, muss sich das abgespaltene oder irgendein H-Atom wieder an das Asymmetriezentrum anlagern. Dafür gibt es dann zwei Möglichkeiten – die beiden Enantiomere entstehen bzw. es entstehen Epimere, wenn das Gesamtmolekül noch weitere Asymmetriezentren aufweist, die (zunächst) nicht von der Konfigurationsverdoppelung betroffen sind. Epimere sind Diastereomere*, die sich in der Konfiguration an nur einem von mehreren Asymmetriezentren unterscheiden.
(b) Wenn ein asymmetrisch substituiertes Kohlenstoffatom eine Hydroxyl-(OH-)Gruppe trägt, die unter schwach sauren Bedingungen als Wasser abgespalten werden kann. Dabei entsteht intermediär ein Kation. Lagert sich Wasser dort wieder an, kommt es zu demselben Prozess von Racemisierung oder Epimerisierung, der unter (a) beschrieben ist. Dieser Prozess findet besonders leicht statt, wenn das Asymmetriezentrum direkt drei weitere Kohlenstoffatome trägt.
Aus Vorstehendem folgt: Die Übertragung eines eventuellen Enantiomerenüberschusses der alpha-Methylaminosäuren würde nach unserem chemischen Wissen nur gelingen, wenn die dafür benötigten Stoffe und Reagenzien in sehr kontrollierter Weise miteinander zur Reaktion gebracht und die gewünschten Produkte sorgfältig vor Racemisierungsprozessen geschützt würden.
|
|
Verstärkung des übertragenen Überschusses
Ohne Amplifikation (Verstärkung) eines nach vorstehenden Überlegungen gebildeten Enantiomerenüberschusses kann es auf dem noch recht langen Weg zum Leben nicht weitergehen. Für die Amplifikation schlägt Breslow (2012) eine recht simple Arbeitsmethode vor, die bereits 1969 publiziert wurde (Morowitz 1969), dann vergessen wurde, bis sie ohne Erwähnung der älteren Arbeit wieder publiziert wurde (Breslow 2006, Klussman et al. 2006, Klussmann et al. 2007, Noorduin et al. 2008). Die Methode besteht in der jedem Chemiker bekannten fraktionierten Kristallisation*, bei der man ausnutzt, dass in einer Mischung die schwerst lösliche Komponente zuerst ausfällt, wenn man etwas Lösungsmittel verdampft. Bei alpha-Aminosäuren ist das Racemat schlechter wasserlöslich als die einzelnen Enantiomere, die in Wasser prinzipiell dieselbe Löslichkeit haben. Man benötigt also ein Szenario, in dem eine gesättigte wässrige Lösung einer der proteinogenen Aminosäuren vorliegt. Verdünnte Lösungen gehen nicht, da nichts ausfallen würde bzw. sie müssten erst konzentriert werden. „Natürlich“ dürfen auch keine Komponenten vorhanden sein, die mit den Aminosäuren reagieren. Es dürfen auch keine Komplex- oder Salzbildner vorhanden sein, die das Löslichkeitsgeschehen verändern. Es dürfen keine Kokristallbildner vorhanden sein, z. B. andere Aminosäuren. Und es muss ein Prozess vorhanden sein, der das ausgefallene Racemat vom noch gelösten kleinen Überschuss des reinen Enantiomers trennt. Es ist keine Überraschung, dass man Aminosäuren auf diese Weise durch Kristallisation und nachfolgendes Abtrennen der Kristalle auftrennen kann. Das ist einfach, das ist Basischemie. Das Geschehen in seiner Gesamtheit ist aber nicht einfach. Er erfordert Einfallsreichtum, Geschick und Zielbewusstsein. Alle (absolut wesentlichen!) aufgezählten „Rand“bedingungen müssen gegeben sein. In einem naturalistischen Rahmen müssten sie das selektierende, reinigende und zielführende Handeln des Denkers oder Operateurs ersetzen. Das überfordert Kristalle und Kristallisationsvorgänge sehr stark.
|
|
Gefährliche molekular spiegelbildliche Dinosaurier
Breslow diskutiert (Breslow 2012) weitere Überlegungen zur Bildung von D-Zuckern und D-Ribonucleotiden, auf die hier nicht eingegangen werden soll, da sie nicht direkt mit der Frage der Homochiralitätsentstehung zu tun haben.
Er schließt seinen Artikel mit einer überraschenden, die Naturwissenschaft verlassenden Warnung: „Diese Arbeit impliziert, dass es anderswo im Universum Lebensformen geben könnte, die auf D-Aminosäuren und L-Zuckern basieren, in Abhängigkeit von der Chiralität des circular polarisierten Lichtes im dortigen Sektor des Universums oder eines anderen Prozesses, der zugunsten der L-alpha-Methylaminosäuren stattfand, die von Meteoriten auf die Erde gebracht wurden. Solche Lebensformen könnten fortgeschrittene Versionen von Dinosauriern sein, wenn die Säuger dort nicht das Glück hatten, dass die Dinosaurier von der Kollision mit einem Asteroiden ausgelöscht wurden wie auf unserer Erde. Es wird uns sicher besser gehen, wenn wir ihnen nicht begegnen“ (Breslow 2012; übersetzt von P. I.).
 |
| In einem naturalistischen Rahmen entfällt das selektierende, reinigende und zielführende Handeln eines Operateurs. |
 |
|
Das ist eine erstaunliche Passage in einem der international renommiertesten Fachjournale der Chemie. Zunächst: Es ist physikalische Spekulation, ja Unmöglichkeit, dass es Teile des Universums mit rechts und Teile mit links circular polarisiertem Licht gibt, jedenfalls wenn man an so etwas wie die Gültigkeit der auf der Erde formulierbaren Naturgesetzlichkeiten auch im All glaubt. Daher müssen wir im zeitlichen und räumlichen Mittel mit Meteoriten rechnen, die uns sowohl L- als auch D-alpha-Methylaminosäuren zutrugen und zutragen. Das würde zu einer Ausmittelung der hypothetischen Effekte auf die Entstehung „unserer“ proteinogenen Aminosäuren führen. Aus den sehr wenigen Meteoritenbruchstücken mit 0-19% Enantiomerenüberschuss dieser Aminosäuren zugunsten der L-Formen wird man nicht auf das gesamte Geschehen innerhalb der konventionell angesetzten Jahrmillionen schließen. Überhaupt zeugt es von großem spekulativen Wagemut, ein paar für jetziges Leben nicht notwendige Aminosäuren aus ein paar kosmischen Steinstückchen als die Samen („seeds“) des Lebens anzusehen. Das hat fast spirituelle, jedenfalls glaubensgeleitete Züge.
Die Warnung vor den molekular spiegelbildlichen hypothetischen Dinosauriern anderer Erden wäre bei einem weniger prominenten Wissenschaftler und einem weniger weltanschaulich beladenen Thema wahrscheinlich vom Peer-Review-System nicht durchgelassen worden. Mit Chemie hat sie nichts mehr zu tun, vielleicht noch mit ein bisschen Chemie-„Szenarien“ (chemical fiction). Breslows Ausführungen setzen merkwürdigerweise Folgendes voraus: Außerirdische, wenn sie stärker als „wir“ sind, werden uns gefährlich sein. Warum wird das automatisch angenommen? Aus ihrer D-Aminosäure- und L-Zucker-Konstitution wird man es wohl nicht direkt ableiten wollen, geschweige denn können. Vielleicht darf man hier auch einmal fernab der Chemie spekulieren, freilich anders als Breslow und anders als Herbert George Wells in seinem Roman „Der Krieg der Welten“. Mit Clive Staples Lewis in seinem Roman „Jenseits des schweigenden Sterns“ sei also fröhlich postuliert: Vielleicht sind große Außerirdische auf ganz andere Weise groß: Großmütig, groß in Langmut und groß in Barmherzigkeit mit den gernegroßen Gedanken der Erdlinge?
|
Anmerkungen
1 Es gibt keinen grundsätzlichen schöpfungstheoretischen Einwand, Bakterien oder überhaupt Lebewesen außerhalb der Erde für unmöglich zu erachten. Wenn z. B. auf dem Mars oder Mond oder Kometen Leben gefunden würde, wäre die Frage dieselbe wie die Frage nach der Herkunft des Lebens auf der Erde: Entstand es „von allein“ (ateleologisch-naturalistisch) oder wurde es geschaffen? Wir haben für das Leben auf der Erde im christlichen Denkrahmen offenbarte Aussagen des Schöpfers. Sie schließen nicht aus, dass Lebewesen auch andernorts geschaffen wurden.
|
|
|
Literatur
- Breslow R & Levine M (2006)
- Amplification of enantiomeric concentrations under credible prebiotic conditions. Proc. Natl. Acad. Sci. USA 103, 12979-12980.
- Breslow R, Levine M & Cheng Z (2010)
- Imitating Prebiotic Homochirality on Earth. Orig. Life Evol. Biosph. 40, 11-26.
- Breslow R (2012)
- Evidence for the Likely Origin of Homochirality in Amino Acids, Sugars, and Nucleosides on Prebiotic Earth. J. Am. Chem. Soc. DOI: 10.1021/ja3012897
- Chruma J, Liu L, Zhou W & Breslow R (2005)
- Hydrophobic and electronic factors in the design of dialkylglycine decarboxylase mimics. Bioorg. Med. Chem. 13, 5873-5883.
- Dose K (1987)
- Präbiotische Evolution und der Ursprung des Lebens. Chemie in unserer Zeit 21, 177-185.
- Engel MH, Macko SA & Silfer JA (1990)
- Carbon isotope composition of individual amino acids in the Murchison meteorite. Nature 348, 47-49. DOI:10.1038/348047a0
- Engel MH & Nagy B (1982)
- Distribution and enantiomeric composition of amino acids in the Murchison meteorite. Nature 296, 837-840. DOI: 10.1038/296837a0.
- Flores J, Bonner W & Massey G (1977)
- Asymmetric photolysis of (RS)-leucine with circularly polarized ultraviolet light. J. Am. Chem. Soc. 99, 3622-3625.
- Glavin DP & Dworkin JP (2009)
- Enrichment of the amino acid l-isovaline by aqueous alteration on CI and CM meteorite parent bodies. Proc. Natl. Acad Sci. USA 106, 5487-5492. DOI: 10.1073/pnas.0811618106.
- Klussmann M, Iwamura H, Mathew S, Wells D, Pandya, U, Armstrong A & Blackmond D (2006)
- Thermodynamic control of asymmetric amplification in amino acid catalysis. Nature 441, 621-623.
- Klussmann M, Izumi T, White A, Armstrong A & Blackmond D (2007)
- Emergence of solution-phase homochirality via crystal engineering of amino acids. J. Am. Chem. Soc. 129, 7657-7660.
- Monroe AA & Pizzarello S (2011)
- The soluble organic compounds of the Bells meteorite: Not a unique or unusual composition. Geochim. Cosmochim. Acta 75, 7585-7595. DOI: 10.1016/j.gca.2011.09.041.
- Morowitz HJ (1969)
- Mechanism for the amplification of fluctuations in racemic mixtures. J. Theor. Biol. 25, 491-494.
- Noorduin W, Izumi T, Millemaggi A, Leeman M, Meekes H, Van Enckevort W, Kellogg, R, Kaptein B, Vlieg E & Blackmond D (2008)
- J. Am. Chem. Soc. 130, 1158-1159.
- Orgel LE (2008)
- The Implausibility of Metabolic Cycles on the Prebiotic Earth. PLoS Biology 6, e18. DOI:10.1371/journal.pbio.0060018
- Pizzarello S & Cronin JR (2000)
- Non-racemic amino acids in the Murray and Murchison meteorites. Geochim. Cosmochim. Acta 64, 329-338.
- Pizzarello S, Zolensky M, &Turk KA (2003)
- Nonracemic isovaline in the Murchison meteorite: Chiral distribution and mineral association. Geochim. Cosmochim. Acta 67, 1589-1595. DOI: 10.1016/S0016-7037(00)01283-8
- Pizzarello S (2007)
- The Chemistry of life’s origin: a carbonaceouse Meteorite perspective. Acc. Chem. Res. 39, 231-237.
- Pizzarello S & Groy T (2011)
- Molecular asymmetry in extraterrestrial organic chemistry: An analytical perspective. Geochim. Cosmochim. Acta 75, 645-656.
- Pollock GE, Cheng CN, Cronin SE, Kvenvolden KA (1975)
- Stereoisomers of isovaline in the Murchison meteorite. Geochim. Cosmochim. Acta 39, 1571-1573.
- Shapiro R (2007)
- Ein einfacher Ursprung des Lebens. Spektrum der Wissenschaft (11), 65-72.
|
|  |
